Молекулярная физика
Молекулярно-кинетическая теория
Молекулярная физика-раздел физики, в котором изучаются физ.свойства вещества в различных агрегатных состояниях, на основе рассмотрения их молекулярного строения.
Молекула- мельчайшая частица вещества, сохраняющая его химические свойства.
Количество вещества υ - величина пропорциональная числу молекул N данного вещества.
Моль- количество вещества, в котором содержится столько же молекул, сколько атомов углерода содержится в 0,012 кг углерода C¹².
Число Авогадро-число молекул в одном моле вещества
Na=6,02 ×10²³ моль¯¹
Молярная масса [µ]- масса одного моля вещества.
Основные положения молекулярно-кинетической теории (МКТ)
1.Все вещества состоят из молекул (атомов).
2.Молекулы(атомы) находятся в непрерывном хаотическом движении.
3.Молекулы(атомы) взаимодействуют друг с другом-притягиваются и отталкиваются.
Подтверждение основых положений МКТ
| Прямые | косвенные |
| Наблюдение строения вещества в электронный микроскоп. Прониконовение масла сквозь стенки сосуда под большим давлением. | Диффузия- явление проникновения молекул одного вещества в промежутки между молекулами другого вещества. Броуновское движение-хаотическое движение взвешенных в жидкости или газе частиц под действием ударов молекул жидкости или газа. |
Вещества могут находится в различных агрегатных состояниях
|
|
|
| Соотношение расстояний между частицами с их размерами | Взаимодействие частиц | Характер движения частиц | Свойства вещества | |
| Газообразное состояние Жидкое Твердое | R>d R>d R≈d | Силы взаимодействия чрезвычайно малы Проявляются силы взаимного притяжения и отталкивания Проявляются силы взаимного притяжения и отталкивания | Хаотическое движение. Частицы свободно движутся среди других частиц Колебательно-поступательное Движение Колебательное движение около положения равновесия | Не сохраняет ни формы, ни объема.Могут неограниченно расширяться.Легко сжимаемы. Сохраняют объем, но легко меняют свою форму.Плохо сжимаемы.Текучи. Сохраняют объем и форму.Упруги. Пластичны. |
Идеальный газ
Идеальный газ-модель реального газа, согласно которой:
1)Размеры молекул газа пренебрежительно малы по сравнению с расстоянием между ними.
2)Между молекулами отсутствуют силы взаимодействия.
3)Столкновение молекул газа между собой и стенками сосуда абсолютно упруги
4)Движение молекул подчиняется законам Ньютона.
Основное уравнение МКТ идеального газа
P=⅓nm0
p-давление, n-концентрация молекул(число молекул в еденице объема), m0-масса одной молекул, V¯²-средний квадрат скорости молекул.
|
|
|
Другие формы записи этого уравнения:
P=²/3 nẼ P=⅓ρ V¯²,
Где Ẽк-средняя кинетическая энергия поступательного движения молекул, ρ-плотность газа.
Температура- физическая величина, характерезующая степень нагретости тела.
Измеряется термометрами, действие некоторых (ртутных, спиртовых) основано на тепловом расширении жидкостей при нагревании.
Абсолютная температура-температура измеренная по шкале Кельвина.
Соотношение между абсолютной температурой и температурой по шкале Цельсия:
Т= t +273
Температура - величина пропорциональная средней кинетической энергии хаотического движения молекул:
Ẽ=²/3 кТ,
Где к-постоянная Больцмана,к = 1,38×10¯²³ Дж/К;n – концентрация,Т-абсолютная температура.
Р=nкT
Уравнение состояния идеального газа(Уравнение Менделеева- Клайперона)
Связывает между собой основные параметры, характерезующие состояние газа- давление Р, объем V и температуру Т.
Pv=m/µ RT,
R-универсальная газовая постоянная R=8,31 Дж/К.моль;m-масса газа, µ- молярная масса газа.
При m=const уравнение примет вид:
PV/Т=const
Изопроцессы - процессы, происходящие при постоянном значении одного из параметров состояния(Т,Р,V) с данной массой газа.
| Название процесс | Постоянный парамет | Математическая запись закона | Графики процессов в системе координат p-v. p-T. v-T/ |
| Изотермический Изобарный Изохорный | Т=const P=const V=const | PV=const Закон Бойля-Мариотта P/T=const закон Шарля |
   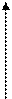   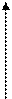 p v p p v p
   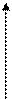   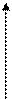               v T T
V p p
T V T
p p v
T V T v T T
V p p
T V T
p p v
T V T
|
 2015-09-06
2015-09-06 552
552






