Электроны в ядре располагаются не как попало, а слоями - энергетическими уровнями. Эти уровни, как этажи в доме - первый, второй, третий и так далее.
Да еще внутри каждого уровня есть электронные подуровни - s, p, d, f, на которых располагаются атомные орбитали соответственно s, p, d, f-типа.
Чем больше номер "этажа" - уровня, тем "выше" (дальше от ядра) находятся электроны этого уровня.
На первом уровне может быть один-единственный s-подуровень,
на втором подуровней уже два: s и p.
На третьем - " три подуровня (s, p и d), на четвертом - четыре (s, p, d, f).
Электронные подуровни, так же, как и энергетические этажи - уровни, различаются по энергии.
Они располагаются на разной энергетической "высоте".
Ученые условились обозначать каждую атомную орбиталь
квантовой ячейкой - квадратиком на энергетической диаграмме:
| На s -подуровне может находиться одна атомная орбиталь, а на p -подуровне их может быть уже три (в соответствии с тремя осями координат): | 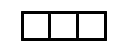 
|
| Орбиталей d - и f -подуровня в атоме может быть уже пять и семь соответственно: | 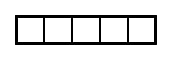 
|
Каждый электрон будем обозначать стрелочкой, направленной вверх или вниз, и заодно сразу договоримся, что в квантовой ячейке можно поместить самое большее два электрона со стрелками, направленными в разные стороны, вот так:
 Свободная Свободная
|  заселенная наполовину заселенная наполовину
|
 заселенная наполовину заселенная наполовину
|  полностью заселенная электронами полностью заселенная электронами
|
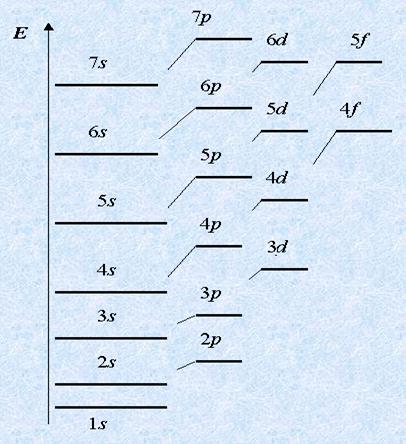
Все электронные уровни и подуровни, которые мы только что изображали в виде диаграмм, характеризуются определенной энергией.
И самое главное: для всех электронов в атоме эта "определенная энергия" имеет отрицательное значение (меньше 0), причем она тем более отрицательна, чем ближе орбиталь к ядру.
В первую очередь заполняется самый выгодный первый энергетический уровень, а уже потом второй, третий и так далее. Причем в пределах одного и того же уровня сначала заполняется тот подуровень, у которого энергия ниже. Например, сначала два электрона попадут на 2s-подуровень, а потом - 2р-подуровень; сначала 3s-, а потом 3р-подуровень.
А вот дальше начинается путаница: после 4s заполняется не 4р, а 3d-подуровень. Но это только на первый взгляд. На самом деле здесь все по правилам, ведь энергия 3d-подуровня ниже, чем 4р. Поэтому он и заселяется электронами раньше.
Заселение атомных орбиталей электронами. Правило минимума энергии, принцип Паули и правило Хунда
Заселение атомных орбиталей электронами определяется правилом минимума энергии, принципом Паули и правилом Хунда.
Электроны заселяют атомные орбитали, начиная с подуровня с меньшей энергией. В этом состоит правило минимума энергии. Последовательность в нарастании энергии подуровней акова: 1s < 2s < 2p < 3s < 3p < 4s ≤ 3d < 4p < 5s и так далее …
Согласно расчетам, электрон движется не по какой-то определенной траектории, а может находиться в любой части околоядерного пространства - т.е. можно говорить лишь о вероятности (возможности) его нахождения на определенном расстоянии от ядра.
Электроны в атоме занимают самые энергетически выгодные атомные орбитали (орбитали с минимальной энергией), образуя электронные облака определенной формы.
В случае s-орбитали электронное облако сферическое:
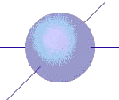
В случае p-орбиталей форма электронного облака гантелеобразная:  ...
...
Внутри атомных орбиталей вероятность нахождения электронов велика; иными словами, имеется высокая электронная плотность. Пространство вне объема орбиталей соответствует малой электронной плотности.
В каждой атомной орбитали может размещаться максимально два электрона (принцип Паули).
При наличии орбиталей с одинаковой энергией (например, трех р-орбиталей одного подуровня) каждая орбиталь заполняется вначале наполовину (и поэтому на р-подуровне не может быть более трех неспаренных электронов), а затем уже полностью, с образованием электронных пар (правило Хунда).
Число возможных подуровней равно номеру уровня. Первый уровень состоит из одного
s-подуровня. Второй уровень состоит из двух подуровней – s и р. Третий уровень – из трех подуровней – s, p и d.
На каждом подуровне может находиться строго ограниченное число электронов:
на s-подуровне – не больше 2е;
на р-подуровне – не больше 6е;
на d-подуровне – не больше 10е.
Подуровни одного уровня заполняются в строго определенном порядке: s  p
p  d.
d.
Таким образом, р-подуровнь не может начать заполняться, если не заполнен s-подуровень данного энергетического уровня, и т.д.
Энергетические диаграммы электронных оболочек атомов водорода и гелия:
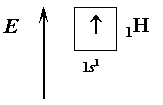
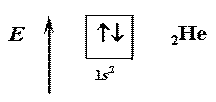
атом водорода может потерять свой единственный электрон, который является и внешним, и валентным, и превратиться в катион водорода:
H0 − 1 e− = H+
Это означает, что водород окисляется – участвует в процессе окисления. Но атом водорода может и восстановиться – принять электрон. В процессе восстановления получится анион водорода, который еще называют гидрид-анионом:
H0 + 1 e− = H−
Атом углерода уже становится способен не только отдать свои электроны – окислиться, но и принять – восстановиться:
C0 − 4 e− = C+IV
C0 + 4 e− = C−IV
Реальные катионы и анионы углерода не существуют, поэтому в приведенных здесь уравнениях реакций написаны символы атомов углерода в степени окисления +IV и −IV.
Степень окисления – это условный заряд, который могут иметь атомы различных элементов в химических соединениях.
Некоторые закономерности в Периодической таблице Д.И. Менделеева.
Периодическая таблица систематизирует не только элементы, но и самые разнообразные их свойства. Химику часто бывает достаточно иметь перед глазами Периодическую таблицу для того, чтобы правильно ответить на множество вопросов (не только экзаменационных, но и научных).
Заглянем еще раз в Периодическую таблицу. Помимо глубокой фундаментальной связи между элементами, она отражает ряд полезных для изучения химии закономерностей. Рассмотрим важнейшие из них (рис.).
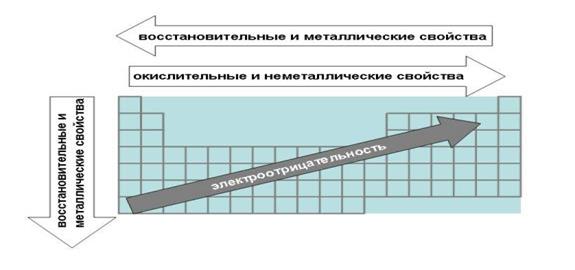
Рис. Закономерности Периодической таблицы, связанные с электроотрицательностью, металлическими и окислительно-восстановительными свойствами элементов.
а) Закономерности, связанные с металлическими и неметаллическими свойствами элементов.
1. При перемещении вдоль периода СПРАВА НАЛЕВО металлические свойства элементов УСИЛИВАЮТСЯ. В обратном направлении возрастают неметаллические.
Это объясняется тем, что правее находятся элементы, электронные оболочки которых ближе к октету. Элементы в правой части периода менее склонны отдавать свои электроны для образования металлической связи и вообще в химических реакциях.
Например, углерод - более выраженный неметалл, чем его сосед по периоду бор, а азот обладает еще более яркими неметаллическими свойствами, чем углерод.
Слева направо в периоде также увеличивается и заряд ядра. Следовательно, увеличивается притяжение к ядру валентных электронов и затрудняется их отдача.

в) Закономерности, связанные с размерами атомов.
6. Размеры атомов (АТОМНЫЕ РАДИУСЫ) при перемещении СЛЕВА НАПРАВО вдоль периода УМЕНЬШАЮТСЯ. Это объясняют тем, что электроны все сильнее притягиваются к ядру по мере возрастания заряда ядра. Даже увеличение числа электронов на внешней оболочке (например, у фтора по сравнению с кислородом) не приводит к увеличению размеров атома. Наоборот, размеры атома фтора меньше, чем атома кислорода (рис. 4).
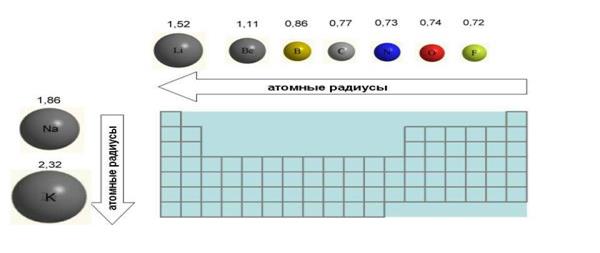
Рис. Изменение атомных радиусов на примере элементов 2-го периода и 1-й группы Периодической таблицы. Атомные радиусы даны в ангстремах (1 А = 10-8 см).
7. При перемещении СВЕРХУ ВНИЗ АТОМНЫЕ РАДИУСЫ элементов РАСТУТ, потому что заполнено больше электронных оболочек.
Периодический закон Д.И.Менделеева: свойства химических элементов, а также свойства простых и сложных веществ, образованных ими, находятся в периодической зависимости от заряда ядер их атомов.
Физический смысл периодического закона: свойства химических элементов периодически повторяются потому, что периодически повторяются конфигурации валентных электронов (распределение электронов внешнего и предпоследнего уровней).
 2015-10-16
2015-10-16 3820
3820