Фаза - это однородная часть системы, отделенная от других частей поверхностью раздела, при переходе через которую скачком изменяется структура вещества или химический состав. Внутри фазы силы притяжения и отталкивания между молекулами взаимно компенсируются. На молекулы вблизи поверхности действует нескомпенсированная результирующая сила, направленная внутрь. Поверхность S имеет искаженную структуру. На поверхности Есв больше, чем внутри фазы.
Традиционно различают три агрегатных состояния вещества: газообразное, жидкое и твердое. Состояние зависит от соотношения потенциальной энергии взаимодействия частиц и их кинетической энергии.
Кинетическая энергия Wкин обусловливает 2 типа движения частиц в среде:
1 - “ колебательное” движение в ограниченной области пространства,
2 - “дрейфовое” движение по всему пространству.



 Wкин дрейф
Wкин дрейф
колебания
Т1 Т2 Тотн
Твердое тело Жидкость Газ
Рис. Качественная характеристика агрегатных состояний вещества.
|
|
|
(Т1 - температура плавления, Т2 - температура испарения)
Твердому состоянию характерен колебательный тип, газообразному - дрейфовый. В жидком состоянии частицы и дрейфуют и колеблются. Изменение энергии зависит, в основном, от изменения температуры Т и давления Р. При определенном соотношении Р и Т происходят фазовые превращения вещества:
в газообразное - испарение (из жидкого), сублимация (из твердого).
в жидкое - плавление (из твердого), конденсация или сжижение (из газообразного),


 в твердое - затвердевание (кристаллизация или стеклование).
в твердое - затвердевание (кристаллизация или стеклование).
Р
Твердое
тело Жидкость Рис. Фазовые превращения вещества
в зависимости от давления Р и
температуры Т.
Газ
Т
Фазовые превращения могут быть длительными (годы, века) и быстрыми (10 -3 с - в «жидкой броне», 10-11 с – в сверхпроводящих логических элементах с эффектом Джозефсона.
Фазовые равновесия.
Твердые вещества по своему составу делятся на одно- и многокомпонентные. Многокомпонентные вещества представляются в виде
- твердых растворов,
- механических смесей,
- химических соединений.
Твердый раствор представляет собой упорядоченное сочетание нескольких компонентов. Как и в жидких растворах, имеются растворитель и растворяемый (растворенный). В зависимости от расположения растворяемых атомов растворы бывают - замещения и внедрения.
В растворе замещения растворяемые атомы занимают позиции атомов растворителя в узлах кристаллической решетки. Неограниченной взаимной растворимостью обладают компоненты, имеющие одинаковые
- тип химической связи.
- тип кристаллической решетки,
- приблизительно (в пределах 15%) параметры кристаллической решетки.
|
|
|
Этим требованиям удовлетворяют:
Ge - Si - термоэлектрический материал, Cu - Zn - конструкционный материал,
Cr - Fe - резисторы, магнитные детали.
Невыполнение требований серьезно уменьшает растворимость.
В растворе внедрения растворяемые атомы занимают междуузельные положения. Это возможно лишь при малом размере растворяемых атомов.
В механической смеси компоненты неограниченно растворимы в жидком состоянии, в твердом нерастворимы (не вписываются в кристаллическую решетку) и не образуют химических соединений.
В химическом соединении
- кристаллическая решетка отличается от решеток компонентов, из которых оно образовано,
- соотношение чисел атомов соответствует стехиометрическому соотношению Аn Bm.
Описание многокомпонентной системы.
Вариантность системы “ n” - число степеней свободы - это число внешних и внутренних факторов (обычно это температура Т, давление Р, концентрация Х), которые можно менять, не изменяя числа фаз в системе.
Система из “К” компонентов, каждый из которых обладает массой “М1”,... “Мк”, с числом фаз “Ф” имеет массу системы в целом:
М = 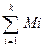 ,
,
массовые доли компонентов - концентрацию:
Х1 = М1/М, Х2 = М2/М,... Хк = Мк/ М, Х1 + Х2+....+ Хк = 1.
Правило фаз Гиббса:
n = К 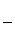 Ф + 2.
Ф + 2.
Для изображения фазового состава системы используются диаграммы состояний (ДС) при различных значениях независимых переменных (обычно температуры Т и концентрации Х). Для равновесных условий ДС позволяют определить вариантность системы “n”, относительное количество каждой фазы, ее состав и вид.
Диаграмма состояния однокомпонентной системы (К=1).
Вариантность: n = 1 - Ф + 2 = 3 - Ф,
т.е. число степеней свободы определяется числом фаз.

 Р 2 3
Р 2 3
 |
 4 Рис. Диаграмма состояний воды.
4 Рис. Диаграмма состояний воды.
Жидкость

 Твердое Поля 1, 2 и 3 - полиморфные
Твердое Поля 1, 2 и 3 - полиморфные
тело превращения льда при высоких
1 Ао давлениях.
5 Пар
 Т
Т
Площади “1”... “5” - геометрические образы фаз - поля. Каждому полю соответствует одна фаза.
Внутри поля - Ф = 1, n = 2 - дивариантное равновесие: возможно независимое изменение двух параметров и Т и Р в пределах поля, не выходя за его границы.
Граница полей: Р = f (T) - Ф = 2, n = 1 - моновариантная система: произвольно можно выбрать только один параметр (чтобы остаться на границе второй параметр будет зависеть от первого).
Ао - тройная точка - одновременное существование 3-х фаз - Ф = 3, n = 0, нонвариантная система. Для воды точка Ао может существовать только при
Т = 0.0075 ОС и Р = 610. 6 Па (4.58 мм рт. ст.).
Если при экспериментальном исследовании однокомпонентной системы, для двухфазного состояния (Ф=2) получается не линия, а поле, то это означает, что вещество недостаточно чистое - система двухкомпонентна, есть примесь.
Диаграмма состояния твердого раствора двухкомпонентной системы.
 Т
Т

 Жидкая фаза L B` 1062°С
Жидкая фаза L B` 1062°С  . A`aB` - ликвидус
. A`aB` - ликвидус
a m b A`bB` - солидус


 To amb - конода
To amb - конода
a + L a, b - фигуративные точки
A`
960.8 ° С Рис. Диаграмма состояний. cплава Ag-Au (“электрон”).
Твердая фаза (a)
 |
(Ag)А Хв% ® Хm В (Au)
Ликвидус (А`aB`) - линия, характеризующая состав жидкой фазы предельной концентрации и температурную зависимость этой концентрации. Выше линии ликвидуса все компоненты находятся в жидкой фазе. Солидус (А`bB`) - линия, характеризующая состав твердой фазы предельной концентрации и температурную зависимость этой концентрации. Ниже линии солидуса все компоненты находятся в твердой фазе. Область между ликвидусом и солидусом - двухфазная (L + a).
Конода (а - b) - отрезок изотермы в двухфазной области.
Фигуративная точка (а, b) - точка, характеризующая состояние сплава: его концентрацию Хm и температуру То.
Отношение массовых частей фаз (Мтв и Мж), находящихся в равновесии при данной температуре, обратно пропорционально отношению отрезков коноды, заключенных между фигуративными точками сплава и соответствующих фаз:
|
|
|
Мтв/ Мж = m a/ m b, Мтв / М = m a / a b, Мж / М = m b / a b.
Эти соотношения называются “правилом отрезков” для двухфазного поля.
Диаграмма состояния двухкомпонентной системы с ограниченной
растворимостью.



 Т B 1083° С
Т B 1083° С
L Рис. Диаграмма состояния
A сплава Ag-Cu.

 960°C (Припой ПСр-72).
960°C (Припой ПСр-72).
 e
e

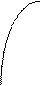
 779°C a +L b + L A e B - ликвидус
779°C a +L b + L A e B - ликвидус
a c a + b d A c d B - солидус
b c e d - эвтектическая
линия
 |
a b
Ag 28.1% Cu
На ДС показано 6 фазовых областей, в том числе
- a - твердый раствор серебра в меди,
- b - твердый раствор меди в серебре,
- a + b - механическая смесь твердых растворов.
Эвтектическая линия - часть солидуса. В сплавах состава от “с” до ”d” при охлаждении происходит кристаллизация из жидкого раствора состава “е” двух твердых растворов состава “с” и “d”:
Le ® ac + bd.
Точка “е” называется эвтектической, а соответствующий ей сплав - эвтектикой. Эвтектика - это мелкодисперсная смесь твердых растворов a и b. Температура плавления эвтектики значительно ниже, чем у каждого из компонентов. Это дает большой энергетический выигрыш при проведения пайки или сварки.
Тугоплавкие припои.
| Припои | Состав, % | Тпл, ˚С |
| ПСр-72 | Ag – 72, Cu - 28 | |
| ПМЦ-54 | Zn – 46, Cu – 54 |
Диаграмма состояния двухкомпонентной системы, образующей механическую смесь.
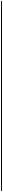
 Т В
Т В
 630°С
630°С
A L
 327.4°C
327.4°C
L+Pb e L+Sb

 246°C
246°C
Эвтек- Эвтектика + Sb
тика +
Pb

Pb 13% Sb
доэвтек эвтект. заэвтектический сплав
Рис. Диаграмма состояния механической смеси свинец – сурьма.
Эвтектический сплав - смесь мелких кристаллов Pb и Sb. Доэвтектический сплав - эвтектика с кристаллами Pb. Заэвтектический сплав - эвтектика с кристаллами Sb. Твердых растворов в такой системе не образуется.
Низкотемпературные припои
| Припои | Состав, % | Тпл, ˚С | |||
| Bi | Pb | Sn | Cd | ||
| Розе | - | ||||
| Липовица | 26.7 | 13.3 | |||
| Вуда | 12.5 | 12.5 |
Диаграмма состояния двухкомпонентной системы, образующей химическое соединение.


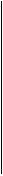 Т С
Т С

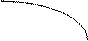
 e2 В
e2 В
L L+AnBm L+AnBm L+B 

 e1
e1

 L+A
L+A
|
|
|
A + AnBm AnBm + B

Рис. Диаграмма состояния химического соединения.
Химическое соединение состава AnBm устойчиво, если при нагревании до температуры плавления (точка С) оно не распадается. Оба компонента А и В и соединение AnBm не образуют в твердом состоянии растворов. Реакция образования эвтектических смесей:
Le1 ® A + AnBm, Le2 ® B + AnBm.
На эвтектических линиях “е1С” и “Се2” из расплава выделяются кристаллы химического соединения. Соотношение компонентов в соединении отражается положением максимума С (соотношение по массе).

 Фактически ДС химического соединения состоит из двух простых ДС.
Фактически ДС химического соединения состоит из двух простых ДС.

 Т 930°С
Т 930°С

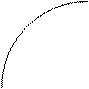 С Рис. Диаграмма состояния
С Рис. Диаграмма состояния
химического соедине-
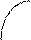
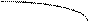 650°С 630°С ния Mg2Sb.
650°С 630°С ния Mg2Sb.



 600°С
600°С
 |
Mg 75% Sb
(№12 – 24,3) (№51 – 121,7)
В результате химического взаимодействия двух металлов может возникнуть интерметаллическое соединение Mg2 Sb, обладающее гораздо большей температурой плавления. Интерметаллические соединения теряют пластические свойства унитарных металлов, становятся хрупкими. Интерметаллические соединения в паяном или сварном шве существенно уменьшают надежность контакта. Проводимость интерметаллидов меньше, т.к. часть свободных электронов идет на формирование анионов сурьмы Sb (5 группа).
Тройные сплавы, по аналогии с химическими соединениями, характеризуются совокупностью ДС бинарных соединений. Зависимость физических свойств (электропроводности, плотности и т.п.) нелинейна для твердого раствора, а для остальных видов – линейна.
 2015-10-13
2015-10-13 7832
7832