ТЕМА АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ
Литература:
Химия 10 класс: учеб.для общеобразоват. учреждений (базовый уровень) / РудзитисГ.Е, Фельдман Ф.Г.
Изучение нового материала
Общая формула ароматических углеводородов СnH2n-6 указывает на сильно непредельный характер.
В 1865 г. В Бюллетене Парижского химического общества была опубликована информация о «Конституции ароматических веществ». Немецкий химик Ф.А. Кекуле предложил структурную формулу бензола:

К этому времени в науке накопились факты, говорящие в пользу формулы Кекуле. Во-первых, в 1866 г П.Бертло (фран. ученый) в электрическом разряде получил бензол. Этот синтез Кекуле назвал «элегантным» объяснением строения бензола. Во-вторых, при дегидрировании циклогексана образуются бензол (Н.Д.Зелинский, 1912 г). В-третьих, при гидрировании бензола образуется циклогексан (Сабатье, 1900). Бензол присоединяет водород, это доказывает его непредельный характер.
Атом углерода в возбужденном состоянии имеет четыре неспаренных электрона. В результате SP2- гибридизации образуются три гибридные орбитали, лежащие в одной плоскости под углом 1200. У каждого атома углерода остается р- орбиталь, перпендикулярная плоскости гибридных орбиталей.








С* 2S 2P
В молекуле бензола гибридные орбитали атома углерода перекрываются с гибридными орбиталями соседних атомов углерода и S- орбиталью атома водорода. Это σ- связи, угол между связями 1200, молекула имеет плоское строение.
Физические свойства бензола (жидкость, с неприятным запахом, легче воды, не растворяется в воде, органический растворитель).
Рассмотрим строение молекулы бензола с точки зрения современных
Химические свойства бензола
| Реакции замещения (как алканы) | Галогенирование | Реакция происходит в присутствии катализатора (соли FeBr3, AlCl3, AlBr3):
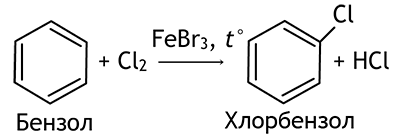
|
| Нитрование | 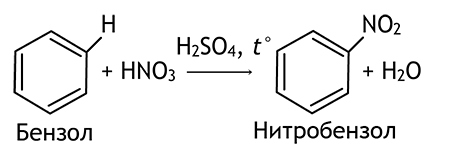
| |
| Алкилирование | 
| |
| Реакции присоединения (как алкены) | Каталитическое гидрирование | 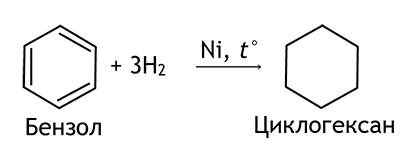
|
| Радикальное хлорирование | 
| |
| Окисление | Горение | 2С6Н6 + 15О2→ 12СО2 + 6Н2О |
| Взаимодействие с перманганатом калия | Не обесцвечивает раствор перманганата калия (реакция не идёт) |
Горение бензола
Бензол горит жёлтым коптящим пламенем, если внести в пламя стекло, на нем быстро оседает слой копоти.
Электрофилы – это положительно заряженные частицы, имеющие свободную орбиталь на внешнем электронном уровне и способные образовывать новые ковалентные связи за счёт пары электронов другой молекулы. К электрофилам относятся молекулы галогенов, SO3 и молекулы с сильнополяризованной связью (HCOO-Br+).
Электрофильное замещение в ароматических соединениях можно представить реакцией присоединения-отщепления. Эта реакция проходит в несколько стадий.

При инициации реакции молекула хлора распадается на два иона. Катализатор, например, AlCl3, присоединяя ион хлора Cl−, приобретает отрицательный заряд. Оставшийся ион хлора Cl+, который является электрофилом, присоединяется к образовавшемуся на катализаторе отрицательному иону AlCl4−.Образованное соединение называется π -комплексом. Этот комплекс вступает в реакцию с молекулой бензола, обеспечивая присоединение ионов хлора Cl+ к атомам углерода.
Закрепление:
Вариант 1
1. Общая формула аренов:
а)CnH2n-6, б) CnH2n-2, в)CnH2n, г) CnH2n+2
2.Атомы углерода в бензола находятся в состоянии гибридизации:
а)sp, б) sp2 , в) sp3
3.В молекуле бензола угол связи равен:
а)900 б)109028 в)1200 г)1800
4. Бензол:
а) обесцвечивает раствор перманганат калия
б) не обесцвечивает бромную воду
в) не вступает в реакции присоединения
5.Бензол:
а) не вступает в реакции присоединения
б) обесцвечивает бромную воду
в) не обесцвечивает раствор перманганата калия
 2020-05-25
2020-05-25 300
300






