Лекция № 14
Термин «биологические насосы» закрепился в литературе с XIX в. Он появился еще до возникновения взгляда на биомембрану как важнейший функциональный компонент клетки. Вначале под биологическими насосами понимали какие-то неизвестные механизмы, которые обеспечивают массоперенос в организме вопреки элементарным законам физики и химии.
В середине XIX в. после блистательных успехов физико-химического изучения жизнедеятельности появились факты, свидетельствующие о том, что всасывание веществ в пищеварительном тракте, мочеобразование и лимфоотделение только отчасти сводятся к процессам фильтрации и диффузии.
Позднее ученые разобрались во многих недоразумениях примитивного приложения законов физики и химии к объяснению явлений жизни. Однако термин «биологические насосы» продолжает жить в биологии. В последние годы с ними зачастую отождествляют ионные насосы − системы активного транспорта Na+, К+, Са2+, Н+ (натрий-калиевую, кальциевую, протонную помпы).
Активный транспорт. Активным транспортом называют трансмембранный перенос веществ в направлении, противоположном транспорту, который должен был бы происходить под действием физико-химических градиентов (прежде всего концентрационного и электрического). Он направлен в сторону более высокого электрохимического потенциала и необходим как для накопления в клетках (или определенных органоидах) веществ, в которых они нуждаются, даже из среды с их низкой концентрацией, так и для выведения из клеток (органоидов) тех агентов, содержание которых там должно поддерживаться на низком уровне, даже при повышении его в окружающей среде.
|
|
|
Свойства систем активного транспорта. Из определения активного транспорта следует, что его важнейшим свойством является перенос веществ вопреки действию физико-химических градиентов (вопреки электродиффузионному уравнению Нернста−Планка), т. е. в сторону более высокого электрохимического потенциала благодаря термодинамическому сопряжению концентрационного и электрического градиентов с расходованием свободной энергии организма. Поэтому система уравнений переноса выглядит так:
 (48)
(48)
Химический потенциал (μх) количественно характеризует вклад ферментативных реакций в свободную энергию биомембраны, необходимую для преодоления сопряженного действия концентрационного и электрического градиентов. Если изменения свободной энергии клетки, обеспечивающие активный транспорт через мембрану, обусловлены макроэргами (АТФ), то в этих уравнениях: v − число молей АТФ, затраченных на массоперенос, а μх равен приросту свободной энергии клетки при гидролизе 1 моля АТФ (в стандартных условиях это составляет 31,4 кДж · моль-1).
|
|
|
Сказанное позволяет сформулировать второе характерное свойство систем активного транспорта − необходимость энергетического обеспечения за счет свободной энергии, выделяющейся либо непосредственно в ходе окислительно-восстановительных реакций (речь идет о так называемой редокс-помпе), либо при гидролизе макроэргов, синтезированных впрок при тех же реакциях. Необходимо подчеркнуть, что свободная энергия, обеспечивающая активный транспорт, черпается биомембранами в ходе химических процессов, связанных непосредственно с переносом веществ через них, т. е. из химических реакций, в которых участвуют сами мембранные компоненты систем активного транспорта. В этом состоит коренное отличие активного транспорта от других способов транспорта веществ через БМ, также нуждающихся в затратах свободной энергии.
Свободная энергия (∆G), затрачиваемая на трансмембранный перенос одного моля вещества в направлении более высокого электрохимического потенциала,
рассчитывается по формуле:
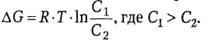
(49)
У человека в покое примерно 30-40% всей энергии, образующейся в ходе метаболических процессов, расходуется на активный транспорт. В некоторых случаях на его обеспечение может затрачиваться почти вся свободная энергия, вырабатываемая клеткой. Ткани, в которых активный транспорт особенно интенсивен, потребляют много кислорода даже в покое. Например, масса мозга человека составляет только 1/50 массы тела, но в условиях мышечного покоя ткани мозга поглощают около 1/5 всего кислорода, усвоенного организмом. Общая мощность всех ионных насосов человеческого мозга − примерно 1 Вт. Почки при угнетении в них активного транспорта ионов снижают свою потребность в кислороде на 70−80%.
Третье свойство систем активного транспорта заключается в их специфичности: каждая из них обеспечивает перенос через БМ только данного вещества (или группы их) и не переносит другие. Правда, активный транспорт ионов натрия бывает сопряжен с пассивным переносом в том же направлении других веществ (например, глюкозы, некоторых аминокислот и т. д.). Это явление называют симпортом. Некоторые системы активного транспорта переносят одно вещество в данном направлении, а другое − в противоположном. Так, калий-натриевая помпа закачивает калий из межклеточной среды в цитоплазму и откачивает натрий из клетки. Такой вид транспорта называют антипортом.
Когда эти ионы начинают перемещаться через БМ в направлении более низкого электрохимического потенциала, то натрий-калиевая помпа становится генератором АТФ. Это явление получило название эффекта обращения систем активного транспорта: на перекачивание ионов в сторону более высокого электрохимического потенциала насосы затрачивают свободную энергию, гидролизуя АТФ, тогда как при движении ионов в противоположном направлении они преобразуют энергию градиентов в энергию макроэргической связи АТФ, синтезируя его из АДФ. Специфичность систем активного транспорта служит одним из самых действенных механизмов селективной проницаемости клеточных мембран и придания им векторных свойств.
Компоненты систем активного транспорта. В составе любой системы активного транспорта веществ через БМ можно выделить три основных компонента: источник свободной энергии, переносчик данного вещества, сопрягающий (регуляторный) фактор. Последний сопрягает работу переносчика с источником энергии. Все компоненты систем активного транспорта образуют сложный молекулярный комплекс в клеточной мембране.
В большинстве известных систем активного транспорта непосредственным источником свободной энергии служит АТФ. За счет присоединения его концевой фосфатной группы, предварительно оторванной при гидролизе, к мембранному переносчику последний фосфорилируется и приобретает дополнительную энергию, достаточную для преодоления физико-химических градиентов, препятствующих движению переносимого вещества. Следовательно, фосфорилированный комплекс переносчика с транспортируемым веществом способен преодолеть потенциальный барьер, неприступный для него до фосфорилирования. Отдавая перенесенное вещество на противоположной стороне БМ, молекулы переносчика дефосфорилируются и теряют энергию.
|
|
|
Реже свободная энергия черпается системами активного транспорта непосредственно из окислительно-восстановительных реакций, т. е. из цепи переноса электронов. Систему активного транспорта с таким источником энергии называют редокс-помпой. Примером может служить перенос Н+-ионов через внутреннюю мембрану митохондрии, обеспечивающий создание протондвижущей силы, при клеточном дыхании.
О переносчиках, обеспечивающих активный транспорт, известно пока немногое. По-видимому, в разных системах активного транспорта работа переносчиков осуществляется посредством различных механизмов. Во-первых, переносчиками могут быть сравнительно мелкие белковые молекулы, присутствующие в БМ. В этом случае молекула переносчика, приняв транспортируемое вещество, проходит всю толщу биомембраны, работая по типу малой или большой карусели. Во-вторых, переносчиками могут служить крупные молекулы мембранных белков, насквозь пронизывающие фосфолипидный бислой. Им, вероятно, свойственны такие механизмы, как ротация или сдвиг.
Третий компонент системы активного транспорта обеспечивает сопряжение работы переносчика с источником энергии. Такое сопряжение может заключаться в переносе фосфатной группы с АТФ на переносчик. Чтобы фосфорилировать переносчик, нужно прежде гидролизовать АТФ. Гидролиз АТФ достаточно эффективен только в присутствии специальных ферментов, называемых АТФазами. Они-то и служат фактором, сопрягающим работу переносчика с источником энергии в основных системах активного транспорта (натрий-калиевой и кальциевой помпах). Название этой ферментной системы употреблено во множественном числе не случайно. Для активного транспорта каждого вещества в тех случаях, когда источником энергии является АТФ, обнаружена специфическая АТФаза. Каждая из транспортных АТФаз активируется именно тем веществом, чей активный транспорт она обеспечивает. Например, Са-активируемая АТФаза переходит в активное состояние только тогда, когда концентрация Са2+ в примембранном пространстве достигает определенного уровня, при котором необходим активный транспорт этого иона.
|
|
|
Все транспортные АТФазы связаны с клеточными мембранами и проявляют высокую специфичность, катализируя реакции, течение которых строго зависит от направления подхода к БМ транспортируемых веществ. Так, Na-K-активируемая АТФаза приобретает активность при взаимодействии с нею натрия внутри клетки, а калия − снаружи. Она не активируется при самых значительных концентрациях натрия в межклеточной среде и калия − в цитозоле.
Зависимость потока (Ф) переносимого вещества через клеточную мембрану от его концентраций по обе ее стороны (С i и Се) при участии транспортной АТФазы описывается уравнением:
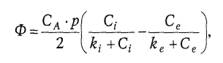 |
(50)
где СА − концентрация АТФазы в биомембране, р − проницаемость мембраны для комплекса «переносимое вещество − фермент», ki и ke − константы диссоциации этого комплекса на внутренней и наружной поверхностях БМ.
В клеточной мембране постоянно присутствуют и переносчики, и транспортные АТФазы, в примембранном пространстве клетки находится АТФ, выходящий из митохондрии, которые подтягиваются к местам активного транспорта. Однако вся система не работает до появления определенного стимула, которым обычно служит нарастание концентрации вещества, подлежащего активному транспорту. Это вещество активирует специфическую АТФазу, которая, в свою очередь, катализирует гидролиз АТФ с отщеплением концевой фосфатной группы. Присоединяясь к переносчику, она фосфорилирует его. При фосфорилировании переносчик приобретает дополнительную свободную энергию, необходимую и достаточную для трансмембранного переноса вещества вопреки действию физико-химических градиентов.
Так, внутри клетки повышение содержания Na+ выше определенного уровня активирует Na-K-активируемую АТФазу, а она − реакцию гидролиза АТФ:
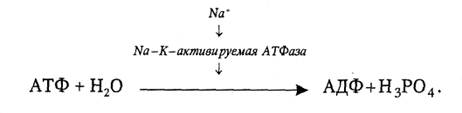 |
Системы активного транспорта ионов. Системы активного транспорта ионов (ионные насосы, ионные помпы) обеспечивают неравновесное распределение этих агентов между клеткой и межклеточной средой, а также среди различных органоидов. Постоянство ионного состава (изоиония) цитозоля и содержимого органоидов является необходимым условием поддержания жизни. Ионы входят в состав всех биологически важных молекул, регулируют эффективность обмена веществ. Все превращения энергии, включая образование и использование макроэргов, контролируются ионами. В организме они составляют сложные тонко сбалансированные внутриклеточную и внеклеточную ионные системы. Малейшее их нарушение неизбежно приводит к нарушению жизнедеятельности. Например, весь клеточный метаболизм чрезвычайно чувствителен к изменению содержания Na+ в цитозоле. При его повышении угнетается синтез белка и усиливается образование липидов. При сохранении высокой концентрации Na+ в цитозоле в течение длительного времени синтез белка также усиливается. Следовательно, ионы натрия выступают в роли регулятора метаболической активности клетки. Подобная функция присуща и другим ионам.
Изменение содержания в цитозоле водорода, калия, кальция, магния и других катионов сигнализируют ее метаболическим системам о малейших нарушениях клеточной целостности, которая достигается относительной обособленностью химического состава клетки при наличии многообразных связей со средой ее обитания.
В организме человека 50% ионов натрия содержится в межклеточной среде (интерстиции), 40% − вкостях и только 10% − внутри клеток. В интерстиции натрию сопутствуют анионы хлора и бикарбоната, концентрации которых там значительно выше, чем в цитозоле. В отличие от этих ионов, а также кальция, катионы калия и магния сосредоточены преимущественно внутри клеток. Из 160 г ионизированного калия, входящего в состав тела человека среднего роста и массы, только 3 г приходится на межклеточную среду. В цитозоле Са2+ присутствует в ничтожной концентрации (около 10-8 моль · л-1) даже в мышечных волокнах, где его содержание довольно велико, но там он сосредоточен не в цитозоле, а в цистернах саркоплазматической сети, мембрана которой в несокращающихся мышцах служит непреодолимым препятствием для перемещения этого иона.
Стабильное поддержание ионного неравновесия, а также перемещение ионов через клеточные мембраны в сторону более высокого электрохимического потенциала для осуществления многих физиологических процессов обеспечивается работой ионных насосов.
Калий-натриевый насос. Только благодаря системе активного транспорта Na+ и К+ поддерживаются стабильные и весьма высокие градиенты концентраций этих ионов на плазмолемме любой клетки. Разница в их молярных концентрациях
между цитозолем и интерстицием достигает 10−20, причем калия больше в цито-золе, а натрия − в межклеточной среде. Под действием концентрационных градиентов К+ выходит из клетки, a Na+ входит в нее. Пассивный транспорт привел бы к ликвидации ионного неравновесия, но этому мешает работа калий-натриевого насоса. Он беспрестанно откачивает натрий из цитозоля в интерстиций и закачивает К+ в клетку. Установлено, например, что через каждый 1 см2 плазмолеммы нервного волокна кальмара ежесекундно проходит 1010 ионов натрия, на что расходуется пятая часть всей свободной энергии, образующейся у кальмара за счет клеточного дыхания. Следовательно, калий-натриевый насос − весьма энергоемкая система. Энергия затрачивается на антипорт натрия и калия.
Компонентами калий-натриевой помпы являются АТФ (источник энергии) и натрий-калий-активируемая АТФаза (сокращенно − Na-K-АТФаза), которая служит одновременно и сопрягающим фактором, и переносчиком. Этот фермент был открыт в 1957 г. при исследовании активного транспорта натрия через мембраны нерва краба, и с тех пор о Na-K-АТФазе получено сведений больше, чем обо всех мембранных транспортных системах вместе взятых. Созданы антитела к ней.
В состав наиболее высокоочищенных препаратов Na-K-АТФазы, выделенной из почки собаки, входят два главных полипептида. Первый из них − интегральный протеин с неполярными боковыми цепями − имеет молекулярную массу около 135 кДа и, по-видимому, насквозь пронизывает биомембрану. Второй полипептид является сиалогликопротеидом с молекулярной массой 40 кДа. Им образованы активные центры, с которыми вступают во взаимодействие переносимые ионы. Na-K-АТФаза не активна в отсутствие ионов магния, не работает без липидов. Ее активность зависит также от рН вблизи активного центра, на котором адсорбируются ионы натрия. С АТФ взаимодействует высокомолекулярный полипептид, при фосфорилировании которого вся молекула фермента претерпевает механохимические превращения. По приблизительным оценкам, они могут обеспечить как сдвиг подвижных групп молекулы АТФазы относительно ее неподвижной структуры, так и ротацию всей молекулы в биомембране.
Молекулярный механизм использования энергии АТФ для работы калий-натриевого насоса еще не вскрыт. В самом общем виде его сформулировал Д. Скоу в 1957 г. Он предполагал, что на внутренней стороне БМ находятся молекулярные комплексы, способные фосфорилироваться за счет присоединения кон-цевой фосфатной группы АТФ, отщепляющейся при его гидролизе. Фосфорили-рованный транспортный комплекс переносит связанный с ним Na+ на наружную сторону клеточной мембраны, где обменивает его на К+. Приняв ионы калия, он транспортирует их внутрь клетки, после чего дефосфорилируется. Для следующего транспортного цикла ему необходимо новое фосфорилирование за счет гидролиза АТФ. С тех пор как были высказаны общие положения о работе калий-натриевого насоса, появилось много гипотез, конкретизирующих участие в ней Na-K-АТФазы. Ни одна из них не является общепринятой, но все модели активного транспорта натрия и калия предусматривают конформационные превращения транспортной АТФазы, сопровождающиеся ее перемещениями в пространстве биомембраны. Некоторые исследователи полагают, будто калий-натриевая помпа действует по принципу перистальтического насоса, который попеременно открывает и закрывает натриевые и калиевые каналы, расположенные в БМ по соседству с Na-K-АТФазой. Ее конформационные перестройки, обусловленные чередованием фосфорилирования и дефосфорилирования, вызывают изменение проницаемости ионных каналов, работающих в противофазе: когда натриевый канал открыт, калиевый − закрыт, и наоборот. Согласно этой гипотезе, Na-K-АТФаза служит не переносчиком ионов, а своеобразным клапаном в ионных каналах.
Другая гипотетическая схема действия калий-натриевой помпы изображена на рис. 52.
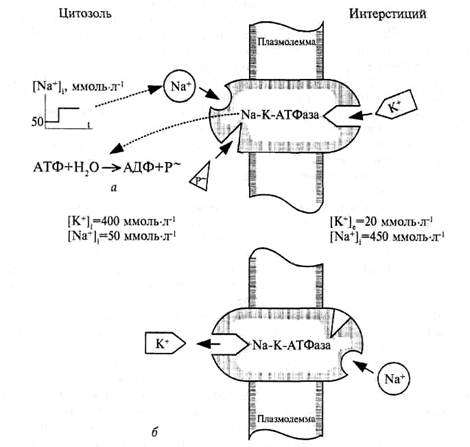
Рис. 52. Схема работы натрий-калиевого насоса: а − состояние до транслокации ионов; б − состояние после транслокации ионов.
Она предполагает, что транспортная АТФаза работает как переносчик. Молекула фермента пронизывает плазмолемму, контактируя одним полюсом с цитоплазмой, а другим − с межклеточной средой. В примембранных участках цитоплазмы скапливаются митохондрии, из которых выходят молекулы АТФ, вступая в непосредственный контакт с мембраной и, следовательно, с Na-K-АТФазой. Содержание ионов натрия в цитоплазме поддерживается на строго постоянном уровне. Так, в нервном волокне кальмара концентрация Na+ составляет 50 ммоль · л-1, а в интерстиции − 450 ммоль · л-1. Концентрационный градиент на мембране волокна достигает 4 · 1013 моль · л-1 · м-1. Он заставляет ионы натрия диффундировать внутрь волокна. Этому же способствует и электрический градиент, обусловленный существованием трансмембранной разности потенциалов, причем цитоплазма несет отрицательный потенциал относительно интерстиция.
Если вследствие пассивного транспорта ионы натрия войдут в цитоплазму и их содержание там превысит 50 ммоль · л-1, то они адсорбируются на Na-K-АТФазе и переведут ее в активное состояние. Активированная АТФаза катализирует гидролиз АТФ, в результате чего от АТФ отщепляется концевая фосфатная группа, которая связывается с 3-карбоксильной группой L-аспарагиновой кислоты, входящей в состав Na-K-АТФазы, и переносит на нее свободную энергию. Фосфорилированная и энергизованная молекула фермента претерпевает конформационную перестройку следствием чего будут ротация или сдвиг ее в плазмолемме. Перемещения в мембране АТФазы вместе с адсорбированными на ней ионами натрия обеспечивают перенос их из цитоплазмы наружу − в сторону более высокого электрохимического потенциала. Оказавшись на внешней стороне плазмолеммы, Ма+ покидает транспортную АТФазу, которая после конформационной перестройки дефосфорилируется. Из межклеточной среды на нее адсорбируются ионы калия, а дефосфорилированная АТФаза приобретает исходную конформацию, вследствие чего ее внешние участки с находящимся там К+ поворачиваются к цитоплазме. Таким образом ионы калия переносятся из интерстиция внутрь клетки тоже вопреки действию концентрационного градиента. Отдав К+ цитоплазме, транспортная АТФаза готова к новому циклу работы, но для этого она должна быть снова фосфорилирована.
Na-K-АТФаза активируется и натрием, и калием, но проявляет при этом ярко выраженную векторность: натрий действует на нее только со стороны цитоплазмы, а калий − из межклеточной среды (рис. 53). Вместе с тем ее специфичность по отношению к натрию выше, чем к калию. Для включения в действие Na-K-АТФазы натрий незаменим, тогда как вместо калия можно использовать любой одновалентный катион, причем с рубидием транспортная система функционирует даже лучше, чем с калием. По-видимому, для фермента характерны разные механизмы распознавания натрия на цитоплазматической стороне плазмолеммы и других катионов на ее наружной поверхности.
Установлено, что за счет гидролиза одной молекулы АТФ осуществляется активный транспорт трех ионов натрия и двух ионов калия, т. е. их сопряженному трансмембранному переносу (антипорту) свойственна стехиометрия. Она сохраняется независимо от величины и направления концентрационного и электрического градиентов.
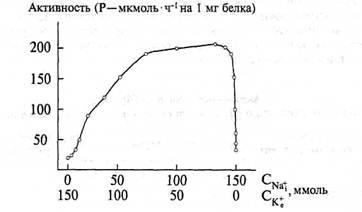 |
Рис. 53. Зависимость активации Na-K-активируемой АТФазы от концентрации Na+ в цитоплазме и К+ во внеклеточной среде; активность АТФазы выражена фосфатом (в мкмоль), высвободившимся за 1 ч (на 1 мг белка)
Стехиометрией обусловлены электрогенные свойства калий-натриевого насоса. Перенося 2К+ внутрь клетки и выводя из нее 3Na+, он создает небольшую разность потенциалов на плазмолемме, причем цитоплазма приобретает отрицательный потенциал относительно интерстиция. Электрогенность ионного насоса подтверждена в эксперименте на искусственных мембранах. Очищенный препарат Na-K-АТФазы, встроенный в липидный бислой, вызывает появление электрического тока через искусственную мембрану. Ток прекращается при добавлении в раствор, омывающий мембрану, специфического ингибитора этого фермента.
В опытах на липидных мембранах, инкрустированных Na-K-АТФазой, установлен также эффект обращения действия ионного насоса. Он состоит в том, что при трансмембранном переносе Na+ и К+ в направлении низких электрохимических потенциалов каждого из этих ионов АТФаза начинает работать в качестве АТФ-синтетазы, т. е. катализировать не гидролиз АТФ, а его синтез из АДФ и ортофосфата. В этом случае калий-натриевый насос служит генератором свободной энергии (в форме АТФ).
Калий-натриевый насос присутствует в плазматических мембранах почти всех клеток животных организмов, но в разных клетках его активность неодинакова. В плазмолемме человеческого эритроцита выявлено от 100 до 300 таких молекулярных «насосиков», а в мембранах почечных эпителиоцитов их примерно на три порядка больше. Содержание Na-K-АТФазы в эритроцитарной мембране не достигает и одного процента общего белка, тогда как в мембранах почечных клеток − более 10%, а в электрическом органе рыб − еще выше.
Очень высока концентрация этого фермента в клетках солевой железы альбатроса. Пожалуй, ни одна птица не может улетать от берега так далеко, как альбатрос, и столь дальние полеты над морем доступны ему только благодаря способности пить морскую воду. В клетках специального органа происходит ее опреснение за счет работы мощного калий-натриевого насоса, локализованного в плазматических мембранах. Лишняя соль выбрасывается из солевой железы в море. Значительна роль калий-натриевой помпы кожи лягушки в жизни этого животного, вышедшего из водной среды на сушу. Она перекачивает ионы натрия из окружающей среды в межклеточную жидкость лягушки даже тогда, когда концентрация натрия в пресном водоеме на четыре порядка ниже, чем в интерстиции животного.
Учитывая многообразие физиологических процессов, обеспечиваемых работой калий-натриевого насоса, можно думать, что существуют разные формы этой транспортной системы в различных органах и у разных представителей животного мира. Полагают, к примеру, что в почках млекопитающих наряду с системой активного антипорта натрия и калия присутствует другой натриевый насос, обеспечивающий симпорт натрия и хлора.
Калий-натриевый насос угнетается различными агентами, из которых наиболее активны сердечные гликозиды, избыток Са+ внутри клетки, а также дыхательные яды. Последние блокируют окислительное фосфорилирование в митохондриях и, нарушая синтез АТФ, лишают ионный насос источника энергии.
Кальциевый насос обеспечивает стабильно низкий уровень Са2+ в цитозоле.
В отличие от калий-натриевого насоса, он выводит из цитозоля избыток ионов не в межклеточную среду, а в органоиды (главным образом, в эндоплазматическую сеть). Поэтому основная локализация кальциевого насоса в большинстве типов клеток − внутриклеточные мембраны, а не плазмолемма. Детальные исследования кальциевой помпы проведены в мембране саркоплазматической сети миоцитов скелетных мышц, где ее активность особенно высока.
Источником энергии для системы активного транспорта кальция служит АТФ. Вторым компонентом насоса является Са2+-активируемая АТФаза (сокращенно − Са-АТФаза). Она состоит из одной полипептидной цепи с молекулярной массой около 100 кДа. В ней преобладают аминокислотные остатки с неполярными боковыми цепями. Это липидзависимый фермент, причем вокруг каждой его молекулы находится примерно 35 молекул фосфолипидов, содержащих ненасыщенные жирнокислотные остатки. Особенно сильным активирующим действием обладают жирные кислоты с одной ненасыщенной связью. Кроме того, для работы Са-АТФазы необходимы ионы магния.
В саркоплазматической сети на долю Са-АТФазы приходится 60% общего мембранного белка. По-видимому, в мембране саркоплазматической сети нет другого интегрального белка, кроме Са-АТФазы. Остальные 40% мембранных протеинов составляют периферические белки. На активный транспорт двух молей Са2+ затрачивается один моль АТФ, но при преодолении очень высоких физико-химических градиентов соотношение Са2+ и АТФ снижается с 2:1 до 1:1.
Механизм действия кальциевой помпы установлен благодаря изучению кинетики ее работы. В этом процессе выделяют три ступени (этапа).
1). Сигналом к активному транспорту служит превышение допустимого уровня Са2+ в цитозоле. Показано, что константа связывания ионов кальция Са-АТФазой имеет порядок 107 л · моль-1, т. е. адсорбция кальция на транспортном ферменте происходит уже при концентрации Са2+ в цитозоле около 10-7 моль · л-1. Са-АТФаза связывает не только Са2+, но и АТФ в комплексе с ионами магния. Центры связывания Са2+ и АТФ локализованы на той поверхности фермента, которая обращена к цитозолю, но это разные центры.
2). Активированная кальцием транспортная АТФаза катализирует гидролиз АТФ, что и составляет основное событие второго этапа в работе кальциевой помпы. При гидролизе от АТФ отщепляется концевая фосфатная группа, присоединяясь затем к Са-АТФазе, которая приобретает при этом дополнительную свободную энергию, равную энергии гидролиза АТФ (примерно 31,4 кДж · моль-1). За счет этой энергии образуется фермент-фосфатный комплекс (Ф~Р).
3). Третий этап работы кальциевого насоса включает переход Са2+ на противоположную сторону мембраны, что обеспечивается изменением конформации Са-АТФазы, приводящим к перемещению молекулы фермента в пространстве БМ. Полагают, что происходит сдвиг подвижных групп Са-АТФазы, на которых адсорбирован Са2+, относительно неподвижной части молекулы. На внешней стороне БМ транспортная АТФаза освобождается от Са2+, поскольку комплекс Ф~Р гидролизуется после того, как затрачивает полученную ранее энергию на активный транспорт ионов. Вслед за гидролизом фермент-фосфатного комплекса происходит дефосфорилирование фермента. Возвращение Са-связывающих центров в исходное состояние является следствием восстановления той конформации молекулы Са-АТФазы, которая свойственна ей в нефосфорилированном состоянии.
В сокращенном виде схема активного транспорта кальция выглядит следующим образом:
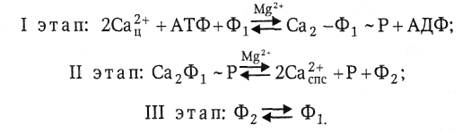
Обозначения в схеме: Са2+ц − кальций в цитоплазме, Са2+спс − кальций в сарко-плазматической сети, Р − ортофосфат, Ф1 − неэнергизованная конформация Са-АТФазы, Ф2 − энергизованная конформация Са-АТФазы.
Кальциевый насос, в отличие от калий-натриевого, не проявляет электрогенных свойств − активный транспорт Са2+ не сопровождается образованием разности потенциалов на мембране саркоплазматической сети. Неэлектрогенность кальциевой помпы обусловлена высокой проницаемостью этой мембраны для многих ионов. Поэтому мембранный потенциал, создаваемый переносом Са2+, сразу падает из-за утечки других ионов.
 2014-02-09
2014-02-09 12538
12538