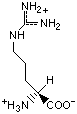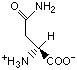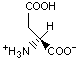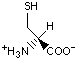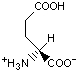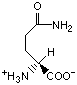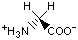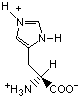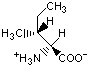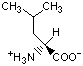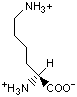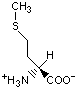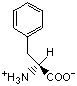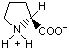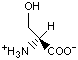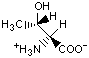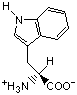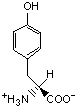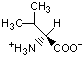
Красный, голубой и жёлтый цвета обозначают аминокислоты с большой, средней и малой гидрофобностью.
Гидрофобность отражает тенденцию неполярных молекул и химических групп растворяться в неполярных растроворителях, что обратно коррелирует со способностью растворяться в воде. Мерой гидрофобности вещества принято считать его коэффициент распределения между органическим растворителем и водой. Самой гидрофильной аминокислотой является глицин.
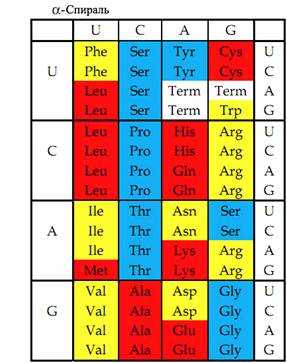
Справа - способность аминокислот к формированию α-спирали в белке.
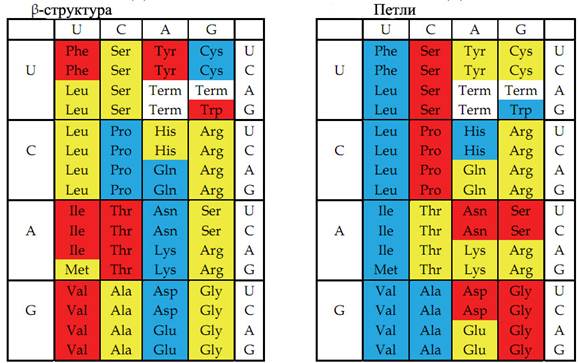
В центре - способность аминокислот к образованию β-складчатых структур.
Справа - способность аминокислот к формированию коротких четырёхаминокислотных β-петель и более длинных петель.
Красный, жёлтый и голубой цвета обозначают аминокислоты с большой, средней и малой способностью к образованию альфа-спирали (слева), β-складчатых структур (в центре) или соответствующей степенью способности к формированию β-петель и более длинных петель (справа).
| Группа | Тип остатка | Аминокислоты | Цветовая легенда |
| Маленькие неполярные остатки | Gly, Ala, Ser, Thr G, A, S, T | Желтый | |
| Гидрофобные | Cys, Val, Ile, Leu, C, V, I, L, Pro, Phe, Tyr, Met, P, F, Y., M, Trp W | Зеленый | |
| Полярные | Asn, Gln, His N, Q, H | Фиолетовый | |
| Отрицательно заряженные | Asp, Glu D, E | Красный | |
| Положительно заряженные | Lys, Arg K, R | Синий |
https://molbiol.ru/appendix/02_01.html
Свойства аминокислот и белков
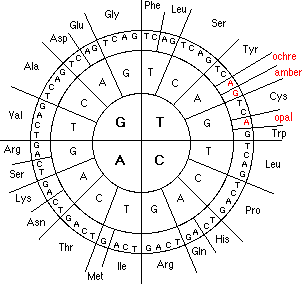
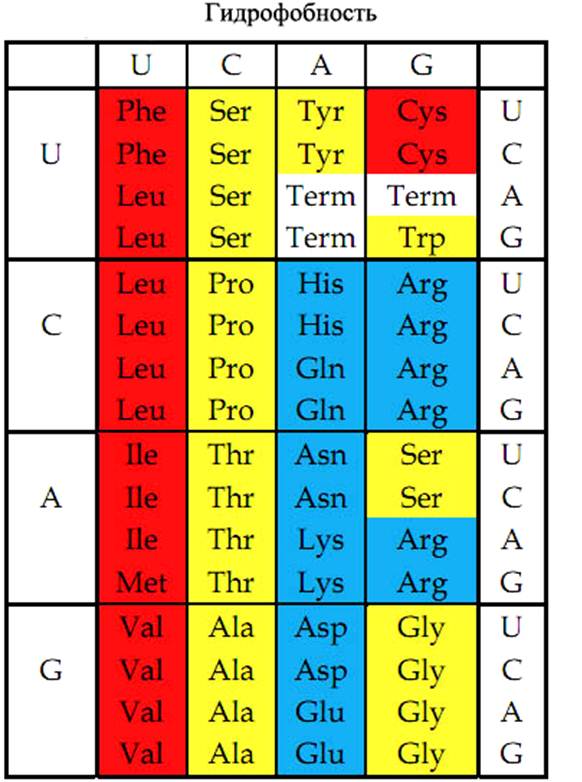
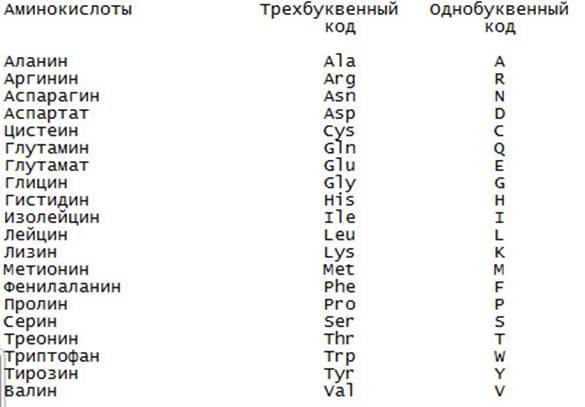
Таблица генетического кода
STOP1 => ochra; STOP2 => amber; STOP3 => opal
Генетический код митохондрий Человеческая митохондриальная ДНК кодирует только 22 типа tRNA. Только эти tRNAs используются при трансляции mRNAs. Такая вырожденность достигается тем, что U в антикодоне tRNA соответствует любому основанию в третьей позиции mRNA (четыре кодона распознаются одним типом tRNA). Кроме того, значение некоторых кодонов не совпадает с универсальным кодом.
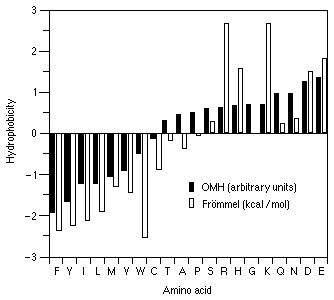
Гидрофобность аминокислот
Гидрофобность аминокислот выражает степень в которой они предпочитают неполярное окружение (этанол в качестве растворителя или внутренность белка) по сравнению с полярным окружением, таким как вода. На этой диаграмме гидрофобные аминокислоты располагаются ниже нуля, а гидрофильные - выше. Используются две шкалы. Шкала Фроммеля (Frommel, 1984) выражает свободную энергию переноса из гидрофобной среды в воду. Это внутреннее свойство аминокислоты, не зависящее от роли аминокислоты в белке. OMH шкала (Sweet and Eisenberg, 1983) - мера того, на сколько вероятна замена данной аминокислоты другой гидрофобной аминокислотой. Frommel, C. 1984. The apolar surface area of amino acids and its empirical correlation with hydrophobic free energy. J. Theor. Biol. 111:247-260. Sweet, R.M. and Eisenberg, D. 1983. Correlation of sequence hydrophobicities measures similarity in three-dimensional protein structure. J. Mol. Biol. 171:479-488. Относительная оценка подобия аминокислот
|

| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
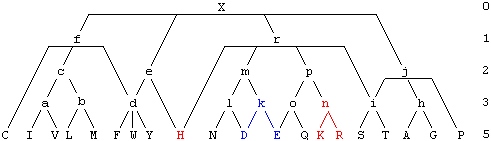
Свойства аминокислот
1 - чем ниже, тем менее вероятна мутация соответствующей АА. 2 - гидрофобность - произвольные единицы основанные на OHM шкале, которые выражают возможность замены одной аминокислоты другой в ходе эволюции. 3 - Hopp, T.P. and Woods, K.R. 1981. Prediction of protein antigenic determinants from amino acid sequences. Proc. Natl. Acad. Sci. U.S.A. 78:3824-3828. 4 - Kyte, J. and Doolittle, R.F. 1982. A simple method for displaying the hydropathic character of a protein. J. Mol. Biol. 157:105-132. 5 - вероятность того, что > 5% поверхности аминокислоты соприкасается с раствором, окружающим белок. Конверсия: масса - моли (белок)
|
 2015-02-27
2015-02-27 1053
1053 Дополнить
Дополнить