Тема № 6. ХИМИЯ НЕМЕТАЛЛОВ
Урок № 71
Тема урока: АММИАК – СТРОЕНИЕ МОЛЕКУЛЫ, ФИЗИЧЕСКИЕ СВОЙСТВА, ПОЛУЧЕНИЕ. ХИМИЧЕСКИЕ СВОЙСТВА АММИАКА.
Цель урока: изучить свойства аммиака, строение молекулы, получение.
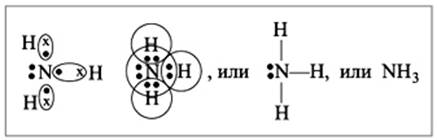
Формула аммиака – NH3, это водородное соединение азота.
Атом азота образует с атомами водорода 3 ковалентные полярные связи за счет своих трех неспареных электронов. Кроме того на атоме азота есть неподеленная электронная пара, способная участвовать в образовании четвертой ковалентной связи по донорно-акцепторному механизму с атомами, имеющими вакантную орбиталь.
Валентность и степень окисления азота в молекуле аммиака
N-3H3+1
NIIIH3I

Физические свойства аммиака
При нормальных условиях — бесцветный газ с резким характерным запахом (запах нашатырного спирта), почти вдвое легче воздуха, ядовит.
По физиологическому действию на организм относится к группе веществ удушающего и нейротропного действия, способных при ингаляционном поражении вызвать токсический отёк лёгких и тяжёлое поражение нервной системы.
Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Это мы и воспринимаем как резкий запах. Пары аммиака вызывают обильное слезотечение, боль в глазах, химический ожог конъюктивы и роговицы, потерю зрения, приступы кашля, покраснение и зуд кожи. Растворимость NH3 в воде чрезвычайно велика — около 1200 объёмов (при 0 °C) или 700 объёмов (при 20 °C) в объёме воды.
Получение аммиака
| В лаборатории | В промышленности |
Для получения аммиака в лаборатории используют действие сильных щелочей на соли аммония:
NH4Cl + NaOH = NH3↑ + NaCl + H2O
(NH4)2SO4 + Ca(OH)2 = 2NH3↑ + CaSO4+ 2H2O
Внимание!Гидроксид аммония неустойчивое основание, разлагается:NH4OH ↔ NH3↑ + H2O
При получении аммиака держите пробирку - приёмник дном кверху, так как аммиак легче воздуха:

| Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота: N2(г) + 3H2(г) ↔ 2NH3(г) + 45,9 кДж Условия: катализатор – пористое железо температура – 450 – 500 ˚С давление – 25 – 30 МПа Это так называемый процесс Габера (немецкий физик, разработал физико-химические основы метода). |
Химические свойства аммиака
Для аммиака характерны реакции:
1. с изменением степени окисления атома азота (реакции окисления)
2. без изменения степени окисления атома азота (присоединение)
| Реакции с изменением степени окисления атома азота (реакции окисления) N-3 → N0 → N+2 NH3 – сильный восстановитель. |
| с кислородом 1. Горение аммиака(при нагревании) 4NH3 + 3O2 → 2N2 + 6H20 2. Каталитическое окисление аммиака (катализатор Pt – Rh, температура) 4NH3 + 5O2 → 4NO + 6H2O |
| с оксидами металлов 2 NH3 + 3CuO = 3Cu + N2 + 3 H2O |
| с сильными окислителями 2NH3 + 3Cl2 = N2 + 6HCl (при нагревании) |
| аммиак – непрочное соединение, при нагревании разлагается 2NH3↔ N2 + 3H2 |
Применение аммиака
По объемам производства аммиак занимает одно из первых мест; ежегодно во всем мире получают около 100 миллионов тонн этого соединения.
Аммиак выпускается в жидком виде или в виде водного раствора – аммиачной воды, которая обычно содержит 25% NH3.
Огромные количества аммиака далее используются для получения азотной кислоты, которая идет на производство удобрений и множества других продуктов. Аммиачную воду применяют также непосредственно в виде удобрения, а иногда поля поливают из цистерн непосредственно жидким аммиаком.
Из аммиака получают различные соли аммония, мочевину, уротропин. Его применяют также в качестве дешевого хладагента в промышленных холодильных установках.
Аммиак используется также для получения синтетических волокон, например, найлона и капрона.
В легкой промышленности он используется при очистке и крашении хлопка, шерсти и шелка.
В нефтехимической промышленности аммиак используют для нейтрализации кислотных отходов, а в производстве природного каучука аммиак помогает сохранить латекс в процессе его перевозки от плантации до завода.
Аммиак используется также при производстве соды по методу Сольве.
В сталелитейной промышленности аммиак используют для азотирования – насыщения поверхностных слоев стали азотом, что значительно увеличивает ее твердость.
Медики используют водные растворы аммиака (нашатырный спирт) в повседневной практике: ватка, смоченная в нашатырном спирте, выводит человека из обморочного состояния. Для человека аммиак в такой дозе не опасен.
ДОМАШНЕЕ ЗАДАНИЕ: создать презентацию по теме «Аммиак».
Ответ на домашнее задание (в виде Microsoft PowerPoint) прислать на электронный адрес:
larisanikolaevna.epgl@yandex.ru
 2020-08-05
2020-08-05 170
170






