Если макроскопические параметры системы имеют одинаковые значения во всем объеме, занимаемом системой, и не изменяются с течением времени, то состояние системы является равновесным.
Равновесные процессы в идеальном газе.
Определение 1.
Определение 2.
Последовательный переход системы из одного равновесного состояния в другое, совершаемый достаточно медленно, так, что в любой заданный момент времени систему можно характеризовать определенными равновесными значениями термодинамических параметров: давления, температуры или объема, что и называется равновесным процессом.
Равновесный процесс представляет собой приближенную модель реального термодинамического процесса.
Рассмотрим, например, сжатие газа поршнем в закрытом сосуде.
Если поршень вдвигать достаточно быстро, то давление поршня на газ не будет успевать распространяться по всему объему, занятому газом. Состояние газа в этом случае нельзя характеризовать определенной величиной давления, оно будет существенно неравновесным. Со временем давление перераспределится по всему объему и состояние газа станет равновесным с новым значением давления.
Определение 3.
Процесс установлениятермодинамического равновесия в системе носит название релаксационного процесса, а время установления равновесия – времени релаксации.
При медленном движении поршня газ проходит последовательно через ряд равновесных состояний, и процесс термодинамически равновесный.
Условие равновесного процесса.
Для того чтобы процесс был равновесным, очевидно, необходимо, чтобы время релаксации в системе было меньше времени, в течение которого система подвергается внешнему возмущению.
4. Виды равновесных процессов.
При изотермическом процессе температура газа остается постоянной в течение всего процесса, то есть, 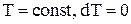 . Уравнение состояния газа в этом случае имеет вид:
. Уравнение состояния газа в этом случае имеет вид:
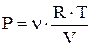 , (1)
, (1)
где v – число молей данного вещества в указанном объеме, 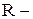 газовая постоянная,
газовая постоянная,
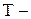 температура,
температура, 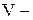 объём.
объём.
В случае изотермического процесса кривые 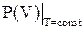 являются гиперболами и называются изотермами.
являются гиперболами и называются изотермами.
Примечание. 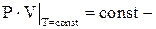 Закон Бойля-Мариотта.
Закон Бойля-Мариотта.
Вычислим работу, производимую газом при изотермическом процессе. Поскольку dT = 0, при изотермическом процессе не изменяется внутренняя энергия газа, dE=0, т.е. все подводимое в систему тепло расходуется только на совершение механической работы и dQ = PdV. Таким образом,
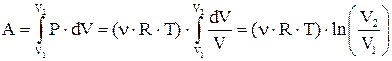 . (2)
. (2)
При изотермическом сжатии газа механическая работа, совершаемая над системой, переходит в тепловую энергию окружающих тел.
 2014-02-09
2014-02-09 532
532






