1. Что подразумевается под фразой «коллигативные свойства растворов»?
А) Отсутствие взаимодействия между молекулами растворенного вещества и растворителя.
Б) Независимость свойств раствора от концентрации растворенного вещества.
В) Зависимость свойств раствора только от счетного числа химических частиц в растворе.
Г) Отсутствие в растворе явлений ассоциации и диссоциации молекул растворенного вещества.
Д) Отсутствие скачкообразного изменения свойств раствора при изменении концентрации растворенного вещества.
2. Какое определение наиболее достоверно характеризует явление осмоса?
А) Явление самопроизвольного поднятия жидкости в капилляре за счет сил адгезии.
Б) Односторонняя самопроизвольная диффузия молекул растворителя через полупроницаемую мембрану из раствора с высокой концентрацией в раствор с низкой концентрацией растворенного вещества.
В) Односторонняя самопроизвольная диффузия молекул растворителя через полупроницаемую мембрану из раствора с низкой концентрацией в раствор с высокой концентрацией растворенного вещества.
|
|
|
Г) Самопроизвольный процесс переноса вещества, в результате которого устанавливается равновесное распределение концентрации по всему объему.
Д) Процесс переноса растворенного вещества через полупроницаемую мембрану в результате самопроизвольной диффузии.
☺ Второй закон Рауля утверждает, что величины понижения температуры замерзания или повышения температуры кипения растворов прямо пропорциональны концентрации растворенного вещества.
3. Укажите способ выражения концентрации растворенного вещества.
А) г/л; Б) моль/л; В) %; Г) Молярная доля; Д) моль/ кг растворителя
4. Почему концентрация раствора выражена через моляльность?
А) При таком способе выражения концентрации число молекул растворителя постоянно.
Б) Потому что растворимость некоторых веществ очень мала.
В) Такой способ не обязателен: для разбавленных растворов можно пользоваться молярной концентрацией.
Г) Так как при этом количество молекул разных растворенных веществ одинаково.
Д) Потому что растворы с одинаковой моляльностью вызывают одинаковое изменение температуры замерзания или кипения в одном и том же растворителе, т. е. обладают коллигативными свойствами.
5. Каков физический смысл коэффициентов пропорциональности – эбуллиоскопической и криоскопической констант?
А) Величина коэффициента показывает, на сколько градусов изменяется температура кипения или замерзания раствора, содержащего 1 моль растворенного вещества в 1 кг растворителя.
Б) Коэффициент пропорциональности указывает на природу растворителя.
|
|
|
В) Это величины, зависящие от удельной теплоты плавления (К кр.) или удельной теплоты испарения (К эб.) растворяемых веществ.
Г) Величина коэффициента показывает, на сколько градусов изменяется температура кипения или замерзания раствора с концентрацией 1 моль/л.
Д) Это величина, численное значение которой зависит от условий растворения: температуры, давления, концентрации, природы растворителя и пр.
☺ Одно из определений закона Вант-Гоффа гласит: «Осмотическое давление равно тому газовому давлению, которое производило бы растворенное вещество, если бы оно в виде газа при той же температуре занимало тот же объем, что и раствор».
6. В каком количестве раствора нужно растворить 1 моль неэлектролита, чтобы при 0оС осмотическое давление равнялось 1 атм.?
А) 1 л; Б) 1 кг; В) 1 моль; Г) 22,4 л; Д) 1 м3
☺ Осмотическое давление, рассчитанное по закону Вант-Гоффа, может не совпадать с давлением, полученным опытным путем, если число химических частиц в приготовленном растворе окажется больше или меньше числа исходных химических частиц. Оценить глубину отклонения позволяет изотонический коэффициент Вант-Гоффа 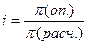
7. В каком случае изотонический коэффициент меньше единицы?
А) При сольватации молекул растворенного вещества.
Б) При высоких концентрациях растворенного вещества.
В) При большом разведении раствора.
Г) При ассоциации молекул растворенного вещества.
Д) При диссоциации молекул растворенного вещества.
☺ Существует две формулировки первого закона Рауля: 1. «Давление насыщенного пара над раствором равно его давлению над чистым растворителем, умноженному на молярную долю растворителя», 2. «При постоянной температуре относительное понижение давления насыщенного пара над раствором нелетучего вещества равно молярной доле этого вещества в растворе».
8. Почему понижение давления пара над раствором считается коллигативным свойством?
А) Так как молярная доля – безразмерная величина.
Б) Потому что уменьшение давления пара зависит только от числа химических частиц в растворе.
В) Потому что закон рассматривает разбавленные растворы нелетучих веществ.
Г) Так как закон не учитывает явления ассоциации или диссоциации молекул растворенного вещества.
Д) Так как закон не предполагает взаимодействия между молекулами растворителя и растворенного вещества.
9. В каких случаях закон нельзя использовать для определения молекулярной массы растворенного вещества?
А) В парах происходит ассоциация молекул растворителя.
Б) Растворенное вещество нелетучее.
В) И растворитель, и растворенное вещество легко испаряются при нагревании.
Г) Растворенное вещество полностью димеризуется в растворителе.
Д) Концентрация раствора превышает 0,05 моль/л.
☺ Изотоничными называются растворы с одинаковым осмотическим давление.
 2015-05-26
2015-05-26 1431
1431








