Найти температурную зависимость ЭДС и значения Е303 (группа 1, вар. 1-10), Е308 (1, вар.11-20), Е313(1, вар.21-30), Е323 (П, вар.1-10), Е328(П, вар. 11-20), Е333 (П, вар.21-30), Е343 (Ш,вар.1-10), Е348 (Ш,вар.11-20), Е253 (Ш,вар.21-30) для токообразующих реакций 1-10 по термодинамическим характеристикам веществ (см.табл.1.1):
1. Zn + 2Cu(OH)2 = ZnO + Cu2О+ 2H2О
2. Zn + 2CuO = ZnO + Cu2О
3. Zn + CuO = ZnO + Сu
4. Zn + Cu2O = ZnO + 2Cu
5. Zn + Cu(ОH)2 = ZnO + Сu + H2O
6. Zn + МпО2 + H2O = ZnO +Mn(OH)2
7. Zn + MnО2 = ZnО+MnO
8. Zn + 2MnО2 + 3H2О = ZnO + 2Мn(ОН)3
9. Zn + 2MnО2 + H2О = Zn(OH)2 + Мn2Оз
10.Zn + 2MnО2 = ZnO + Мn2Оз
1.11.2.Определение термодинамических характеристик веществ по температурной зависимости ЭДС
Задача является обратной задаче 111.1.
Пример
Найти изменение термодинамических функций в реакции Zn+2AgC=ZnCl2+2Ag, если ЭДС гальванического элемента Zn|ZnCl2||AgCl|Ag при 273,2К имеет значение 1,015 В, a dE/dТ = -4,02×10-4 В К-1.
Решение
По величинам Е273,2 и 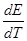 находим DG273,2 и DS:
находим DG273,2 и DS:
DG273,2 = -n×F×Е = -2 96484×1,015 = -174670 Дж/моль;
DS = 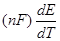 = 2×96484-4,02×10-4 =-77,57Дж/моль×К. По соотношению Гиббса-Гельмгольца рассчитываем DН: DН=DGт+DS×Т=-174670-77,57×273,2= =-195860 Дж/моль.
= 2×96484-4,02×10-4 =-77,57Дж/моль×К. По соотношению Гиббса-Гельмгольца рассчитываем DН: DН=DGт+DS×Т=-174670-77,57×273,2= =-195860 Дж/моль.
 2015-05-22
2015-05-22 713
713








