ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ
К поверхностным явлениям относится совокупность явлений, связанных с особенностями свойств пограничных слоев между двумя соприкасающимися фазами.
В зависимости от агрегатного состояния контактирующих фаз различают поверхностные явления на подвижной и неподвижной поверхности.
1) Подвижные поверхности раздела между жидкостью и газом (ж–г) и двумя несмешивающимися жидкостями (ж–ж). В системах газ-жидкость или жидкость-жидкость поверхность раздела подвижна, так как частицы поверхности постоянно обновляются вследствие теплового движения молекул каждой фазы.
2) Неподвижные поверхности раздела между твердым телом и газом (т–г), твердым телом и жидкостью (т – ж), твердым телом и твердым телом (т–т).
Важнейшее свойство поверхностного слоя состоит в том, что находящиеся в нем молекулы обладают избыточной энергией Гиббса по сравнению с молекулами внутренней части той же фазы.
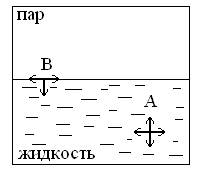
На примере жидкости это можно объяснить следующим образом.
Для внутренних молекул равнодействующая всех межмолекулярных взаимодействий равна 0, а для поверхностных молекул она направлена перпендикулярно поверхности внутрь фазы. Т. е. на молекулу “В”, находящуюся на границе с паром, молекулы жидкости действуют только с одной стороны; со стороны пара силы взаимодействия малы, в результате чего возникает равнодействующая, направленная внутрь жидкости. Поэтому молекулы “В” стремятся втянуться внутрь жидкости, вследствие чего поверхность раздела жидкости стремится к уменьшению. В свободной капле жидкости стремление к уменьшению поверхности приводит к ее сферической (шарообразной) форме. Для выведения молекул на поверхность нужно преодолеть эту силу, т. е. совершить работу и сообщить молекулам определенную энергию и если площадь поверхность увеличивается на какую-то величину, то на какую-то величину возрастает и поверхностная энергия. Величина работы, которую необходимо затратить на увеличение поверхности на 1 см2 численно равна свободной поверхностной энергии на 1см2 поверхности и называется поверхностным натяжением σ (сигма).
Для чистых жидкостей σ зависит от:
1) природы жидкости
2) температуры (уменьшается с ростом температуры)
3) давления на границе жидкость-газ (уменьшается при увеличении давления газа)
Для растворов σ зависит от всех этих факторов (1–3), а также от природы и концентрации растворенного вещества.
Для практического измерения поверхностного натяжения используют следующие методы:
1) Сталагмометрический метод: определяют вес капли, которые отрываются от капилляра. При отрыве вес капли примерно равен силе поверхностного натяжения.
2) Метод продавливания пузырька газа или воздуха через капилляр. Давление p, под которым выдавливается из стеклянного капилляра пузырек газа в жидкость, пропорционально величине поверхностного натяжения на границе раздела
σ ≈ k·p
k – константа капилляра (измеряется на жидкости с известным поверхностным натяжением).
Характеристики гидрофильности поверхности
1) Краевой угол смачивания
Если на твердую поверхность (3) нанесена капля воды (1) и обе поверхности граничат с газом (2) (граница раздела трех фаз), то капля воды образует с твердой поверхностью краевой угол смачивания Θ (тэтта) (угол между твердой поверхностью и касательной к капле).

Из рисунка видно, что если краевой угол смачивания Θ < 90º, то капля имеет сравнительно плоскую форму и как бы растекается по твердой поверхности: капля воды смачивает поверхность – поверхность является гидрофильной.
В предельном случае Θ = 0 смачивание полное и капля полностью растекается по поверхности.
Если Θ > 90, то капля воды приближается по форме к сферической (например, капля воды на парафине). Поверхность в этом случае гидрофобная, с плохим смачиванием водой.
Одно из следствий смачивания – искривление поверхности у стенок сосуда, т.е. образование вогнутого или выпуклого мениска.
2) Теплота (энтальпия) смачивания
Гидрофильность поверхности этим методом определяется отношением теплот ее смачивания водой q1 и исследуемым углеводородом, например, бензолом q2.
Для гидрофильной поверхности 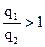
Для гидрофобной поверхности 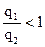
Таким образом, гидрофильные поверхности смачиваются водой с положительным тепловым эффектом.
Например, при смачивании водой поверхности
агара – выделяется 44.8 кал/г
желатина – выделяется 32,5 кал/г
силикагеля – выделяется 22,7 кал/г.
Энергетической характеристикой поверхности системы является поверхностная энергия Гиббса:
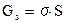
где σ – поверхностное натяжение
S – площадь поверхности
Из термодинамики известно, что всякая система стремится к минимуму энергии. Как видно из формулы, поверхностная энергия может уменьшаться при уменьшении (S) и при уменьшении (σ).
Для чистых жидкостей σ постоянна при данной температуре. При этом площадь поверхности может самопроизвольно уменьшаться, во-первых за счет сферической формы капель; во-вторых, за счет их объединения в более крупные.
Также, площадь поверхности самопроизвольно уменьшается и для растворов. Кроме того, поверхностная энергия может уменьшаться за счет уменьшения σ.
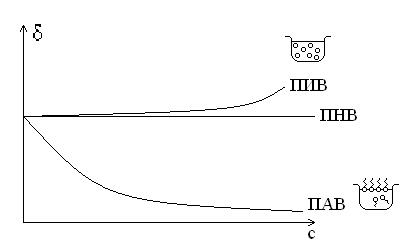
В зависимости от влияния на величину σ растворенные вещества делятся на 3 группы: ПАВ, ПИВ, ПНВ.
1) ПАВ – поверхностно-активные вещества понижают σ растворителя. По отношению к воде ПАВ являются органические вещества.
2) ПИВ – поверхностно-инактивные вещества незначительно повышают σ растворителя. По отношению к воде ПИВ являются неорганические электролиты – кислоты, щелочи, соли.
3) ПНВ – поверхностно-неактивные вещества практически не изменяют σ растворителя. По отношению к воде ПНВ является сахароза.
График зависимости σ от концентрации раствора при какой-либо температуре называется изотермой поверхностного натяжения.
Биологически наиболее важны ПАВ. Молекулы ПАВ состоят из полярных групп –OH, –NH2, –COOH и другие (“голова”) и неполярной углеводородной части (“хвост”).
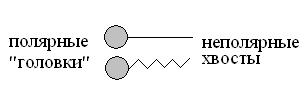
Такое строение придает ПАВ дифильность (двойственность) свойств. Полярная группа гидратируется, что определяет сродство ПАВ к воде – гидрофильность; неполярный радикал обуславливает пониженную растворимость этих веществ в воде и придает ПАВ гидрофобность.
ПАВ в живых организмах – фосфолипиды (ФЛ), белки, нуклеиновые кислоты (НК), желчные кислоты и их соли.
ПАВ используется в фармации для приготовления свечей и мазей, стабилизации эмульсий.
 2015-06-14
2015-06-14 1169
1169







