Коррозия – это самопроизвольный процесс разрушения металлов под действием окружающей среды.
По механизму протекания коррозионного процесса различают химическую и электрохимическую коррозию.
Химическая коррозия – это разрушение металла в результате химического взаимодействия с окружающей средой. Она характерна для сред, не проводящих электрический ток. По условиям протекания коррозионного процесса различают: а) газовую коррозию – взаимодействие металла при высоких температурах с активным газообразными средами O2, H2S, SO2, галогены и др.; б) коррозия в неэлектролитах – агрессивных органических жидкостях, таких, как нефть, нефтепродукты и др. Химическая коррозия встречается сравнительно редко и скорость ее невелика.
Электрохимическая коррозия – это разрушение металла под действием окружающей среды в результате возникновения гальванических пар. Множество микрогальванических пар возникает при контакте различных металлов в среде любого электролита, при наличии примесей в металле, при контакте металла с раствором электролита с различной концентрацией в разных точках раствора, при неоднородных механических напряжениях металла.
|
|
|
При электрохимической коррозии процесс взаимодействия металла с окислителем окружающей среды включает два взаимосвязанных процесса:
а) анодное окисление более активного металла:
Me0 - n 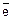 ® Men+
® Men+
б) катодное восстановление окислителя окружающей среды:
- в кислой среде на поверхности катода будут восстанавливаться ионы Н+ и выделяться водород:
2Н+ + 2 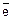 ® Н2
® Н2
- в нейтральной и щелочной средах на поверхности катода будет восстанавливаться молекулярный кислород с образованием гидроксид-ионов:
О2 + 2Н2О + 4 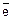 ® 4ОН–
® 4ОН–
Кроме анодных и катодных реакций при электрохимической коррозии происходит длвижение электронов в металле с анодных участков на катодные и движение ионов в электролите. Электролитами могут быть растворы солей, кислот и оснований, морская вода, почвенная вода, вода атмосферы, содержащая CO2, SO2, O2 и другие газы.
Для защиты металлов от коррозии используют различные методы: 1) защитные покрытия (металлические и неметаллические); 2) электрохимическую защиту; 3) легирование металлов; 4) изменение свойств коррозионной среды.
Пример. Хром находится в контакте с медью. Какой из металлов будет окисляться при коррозии? Приведите схемы электрохимической коррозии этой пары металлов в кислой среде (HCl) и атмосфере влажного воздуха.
Решение. Исходя из положения металлов в ряду стандартных электродных потенциалов, хром более активный металл и в образующейся гальванической паре будет анодом, а медь - катодом. Хром будет окисляться, а на поверхности меди в кислой среде будет выделяться водород, в атмосферной среде – гидроксид-ионы. Ионы Cr3+, образующиеся в результате коррозии хрома, в кислой среде образуют с ионами Cl– хлорид хрома CrCl3, в атмосфере – гидроксид хрома Cr(OH)3.
|
|
|
Схема коррозии
в среде HCl в атмосфере влажного воздуха

 А(–): Cr - 3
А(–): Cr - 3 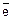 ® Cr3+ 2 А(–): Cr - 3
® Cr3+ 2 А(–): Cr - 3 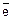 ® Cr3+ 4
® Cr3+ 4
К(+): 2H+ + 2 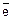 ® H2 3 К(+): O2 + 2H2O + 4
® H2 3 К(+): O2 + 2H2O + 4 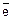 ® 4OH– 3
® 4OH– 3
2Cr + 6H+ ® 2Cr3+ + 3H2 4Cr + 3O2 + 6H2O ® 4Cr3+ + 12OH–
2Cr + 6HCl ® 2CrCl3 + 3H2 4Cr + 3O3 + 6H2O ® 4Cr(OH)3
ПРИЛОЖЕНИЕ
Таблица 1
Термодинамические характеристики некоторых веществ
| Вещество | DНf0, кДж/моль | S0, Дж/моль×К | Вещество | DНf0, кДж/моль | S0, Дж/моль×К |
| Al (к) | 28,31 | H2S (г) | -20,15 | 205,64 | |
| Al2O3 (к) | -1675,0 | 50,94 | К (к) | 64,35 | |
| AlCl3 (к) | -697,40 | 167,0 | КН (к) | -56,9 | 67,95 |
| Al2(SO4)3 (к) | -3434,0 | 239,2 | КОН (к) | -425,93 | 59,41 |
| C (графит) | 5,74 | Li (к) | 28,03 | ||
| СН4 (г) | -74,85 | 186,19 | Li2O (к) | -595,8 | 37,9 |
| С2Н4 (г) | 52,28 | 219,4 | MgO (к) | -601,24 | 26,94 |
| С6Н6 (ж) | 49,04 | 173,2 | MgCO3 (к) | -1096,21 | 65,69 |
| СО (г) | -110,5 | 197,4 | Mn (к) | 32,1 | |
| СО2 (г) | -393,51 | 213,6 | Mn3O4 (к) | -1385,0 | 149,0 |
| CS2 (г) | 115,3 | 237,8 | N2 (г) | 191,5 | |
| СаО (к) | -635,1 | 39,7 | NO (г) | 90,37 | 210,62 |
| СаС2 (к) | -62,7 | 70,3 | NO2 (г) | 33,89 | 240,45 |
| СаСО3 (к) | -1206,0 | 92,9 | N2O (г) | 81,55 | 220,0 |
| Cl2 (г) | 223,0 | N2O4 (г) | 9,37 | 304,3 | |
| Cr (к) | 23,76 | NH3 (г) | -46,19 | 192,5 | |
| Сr2O3 (к) | -1141,0 | 81,1 | NH4Cl (к) | -315,39 | 94,56 |
| Cu (к) | 33,3 | NaCl (к) | -410,0 | 72,36 | |
| CuO (к) | -165,3 | 42,64 | NaOH (к) | -426,6 | 64,18 |
| CuSO4 (к) | -771,1 | 133,3 | O2 (г) | 205,03 | |
| Fe (к) | 27,15 | Pb (к) | 64,9 | ||
| Fe3C (к) | 24,9 | 101,5 | PbO (к) | -217,86 | 67,4 |
| Fe2O3 (к) | -821,32 | 89,96 | S (ромб.) | 31,88 | |
| Fe3O4 (к) | -1117,1 | 146,2 | S2 (г) | 128,0 | 228,0 |
| FeO (к) | -263,68 | 58,79 | SO2 (г) | -296,9 | 248,1 |
| FeS2 (к) | -174,0 | 53,0 | SO3 (г) | -395,2 | 256,23 |
| FeSO4 (к) | -922,57 | 107,51 | V (к) | 28,9 | |
| H2 (г) | 130,6 | V2O5 (к) | -1552,0 | 131,0 | |
| HCl (г) | -92,3 | 186,7 | W (к) | 32,6 | |
| H2O (г) | -241,84 | 188,74 | WO3 (к) | -843,0 | 76,1 |
| Н2О (ж) | -285,84 | 69,96 |
Таблица 2
Растворимость солей и оснований в воде (Р – растворимое, М – малорастворимое,
Р – практически нерастворимое вещество, прочерк означает,
что вещество не существует или разлагается водой)
| Анионы | Катионы | ||||||||||||||||||
| Li+ | Na+, K+ | NH4+ | Cu2+ | Ag+ | Mg2+ | Ca2+ | Sr2+ | Ba2+ | Zn2+ | Hg2+ | Al3+ | Sn2+ | Pb2+ | Bi3+ | Cr3+ | Mn2+ | Fe3+ | Fe3+ | |
| Cl– | Р | Р | Р | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | - | Р | Р | Р | Р |
| Br– | Р | Р | Р | Р | Н | Р | Р | Р | Р | Р | М | Р | Р | М | - | Р | Р | Р | Р |
| I– | Р | Р | Р | - | Р | Р | Р | Р | Р | Р | Н | Р | Р | Н | - | Р | Р | - | Р |
| NO3– | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р | Р | Р | - | Р | Р |
| CH3COO– | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р | - | - | Р | - | Р |
| S2– | Р | Р | Р | Н | Н | - | Р | Р | Р | Н | Н | - | Н | Н | Н | - | Н | Н | Н |
| SO32– | Р | Р | Р | Р | Н | Н | Н | Н | Н | Н | Н | - | - | Н | Н | - | Н | - | Н |
| SO42– | Р | Р | Р | Р | М | Р | М | Н | Н | Р | - | Р | Р | Н | - | Р | Р | Р | Р |
| CO32– | Р | Р | Р | - | Н | Н | Н | Н | Н | Н | - | - | - | Н | Н | - | Н | - | Н |
| SiO32– | Р | Р | - | - | - | Н | Н | Н | Н | Н | - | Н | - | Н | - | - | Н | Н | Н |
| CrO42– | Р | Р | Р | Н | Н | Р | М | М | Н | Н | Н | - | - | Н | Н | Р | Н | - | - |
| PO43– | Н | Р | Р | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| OH– | Р | Р | Р | Н | - | Н | Н | М | Р | Н | - | Н | Н | Н | Н | Н | Н | Н | Н |
Таблица 3
Произведения растворимости малорастворимых
в воде соединений (при 298 К)
| Электролит | ПР | Электролит | ПР | |
| AgCl | 1,6•10-10 | PbCl2 | 1,7•10-5 | |
| Ag2CrO4 | 1,2•10-12 | PbJ2 | 9,8•10-9 | |
| AgBr | 5,0•10-13 | Pb3(PO4)2 | 7,9•10-43 | |
| Ag3PO4 | 1,3•10-20 | MnS | 1,1•10-13 | |
| Ag2CO3 | 6,15•10-12 | Mg(OH)2 | 5,5•10-12 | |
| Ag3AsO4 | 1,0•10-22 | MgCO3 | 1,0•10-5 | |
| AgBrO3 | 5,2•10-5 | Fe(OH)2 | 1,65•10-15 | |
| As2S3 | 4,0•10-29 | CaF2 | 4,0•10-11 | |
| Cu2S | 2,5•10-50 | Ca3(PO4)2 | 1,0•10-25 |
Таблица 4
Константы нестойкости некоторых комплексных ионов
| Схема диссоциации комплексного иона | Константа нестойкости |
| [HgCl4]2– «Hg2+ + 4Cl– | 8,5•10–16 |
| [HgBr4]2– «Hg2+ + 4Br– | 1,0•10–21 |
| [HgJ4]2– «Hg2+ + 4J– | 1,5•10–31 |
| [Hg(CN)4]2– «Hg2+ + 4CN– | 4,0•10–42 |
| [Ag(NH3)2]+ «Ag+ + 2NH3 | 5,7•10–8 |
| [Ag(NO2)2]– «Ag+ + 2NO2– | 1,3•10–3 |
| [Ag(S2O3)2]3– «Ag+ + 2S2O32– | 2,5•10–14 |
| [Ag(CN)2]– «Ag+ + 2CN– | 1,4•10–20 |
| [Cd(NH3)4]2+ «Cd2+ + 4NH3 | 7,5•10–8 |
| [Cd(CN)4]2– «Cd2+ + 4CN– | 1,4•10–19 |
| [Cu(NH3)4]2+ «Cu2+ + 4NH3 | 2,1•10–13 |
| [Cu(CN)4]2– «Cu2+ + 4CN– | 5,0•10–31 |
| [Zn(NH3)4]2+ «Zn2+ + 4NH3 | 3,5•10–10 |
| [Zn(CN)4]2– «Zn2+ + 4CN– | 2,0•10–17 |
| [Fe(CN)6]4– «Fe2+ + 6CN– | 1,0•10–37 |
| [Fe(CN)6]3– «Fe3+ + 6CN– | 1,0•10–44 |
Таблица 5
|
|
|
Стандартные электродные потенциалы металлов
| Электрод | j0, В | Электрод | j0, В |
| Li+/Li K+/K Ba2+/Ba Ca2+/Ca Na+/Na Mg2+/Mg Al3+/Al Ti2+/Ti Mn2+/Mn Cr2+/Cr Zn2+/Zn Cr3+/Cr Fe2+/Fe | -3,045 -2,925 -2,906 -2,866 -2,714 -2,363 -1,662 -1,628 -1,180 -0,913 -0,763 -0,744 -0,440 | Cd2+/Cd Co2+/Co Ni2+/Ni Sn2+/Sn Pb2+/Pb Fe3+/Fe 2H+/H2 Sb3+/Sb Bi3+/Bi Cu2+/Cu Ag+/Ag Hg2+/Hg Pt2+/Pt Au3+/Au | -0,403 -0,277 -0,250 -0,136 -0,126 -0,036 +0,200 +0,215 +0,337 +0,799 +0,854 +1,190 +1,500 |
 2015-06-04
2015-06-04 1173
1173








