В отношении набора всех витаминов уникальна печень. Дрожжи богаты витаминами группы В, рыбий жир – витамином Д. Витамин А содержится в коровьем масле с высоким содержанием молочного жира; витамины Е и F- в растительных маслах (однако последние должны быть абсолютно свежими). Овощи и фрукты богаты, главным образом, витамином С, каротином (особенно много β-каротинов содержится в моркови), фолиевой кислотой и биофлавоноидами. Всех других витаминов в овощах и фруктах мало. Источником витаминов В1, В6, РР является черный хлеб, нежирное мясо, бобовые, орехи; витамина В2 – молоко и молочные продукты. Ценным витаминоносителем (фолата, витамина РР и др.) является куриное яйцо.
Сохранность витаминов. Аскорбиновая кислота – самая нестойкая из витаминов, она легко разрушается на свету и при нагревании. Витамины А, Е, К и провитамин каротин достаточно устойчивы к действию высокой температуры при варке пищи, но очень чувствительны к свету и кислороду воздуха. Тиамин чувствителен к нагреванию.
|
|
|
Таким образом, только разнообразная, полноценная по всем компонентам пища и достаточная по энергетической ценности диета может гарантировать профилактику гиповитаминозов.
Каждый человек должен получать витамины ежедневно, в полном наборе и количествах, обеспечивающих физиологическую потребность организма.
Витамин В1 (Tиамин. Антиневритный витамин)
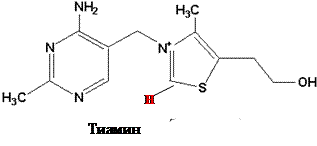 Химическое строение и свойства. Витамин В1 был первым витамином, выделенным в кристаллическом виде К. Функом в 1912 г. Позже был осуществлен его химический синтез. Свое название – тиамин – этот витамин получил из-за наличия в составе его молекулы атома серы и аминогруппы.
Химическое строение и свойства. Витамин В1 был первым витамином, выделенным в кристаллическом виде К. Функом в 1912 г. Позже был осуществлен его химический синтез. Свое название – тиамин – этот витамин получил из-за наличия в составе его молекулы атома серы и аминогруппы.
Тиамин состоит из двух гетероциклических колец – аминопиримидинового и тиазолового. Последнее содержит каталитически активную функциональную группу – карбанион (относительно кислый углерод между серой и азотом).
Тиамин хорошо сохраняется в кислой среде и выдерживает нагревание до высокой температуры. В щелочной среде, например при выпечке теста с добавлением соды или карбоната аммония, он быстро разрушается.
Метаболизм. В желудочно-кишечном тракте различные формы витамина гидролизуются с образованием свободного тиамина. Большая часть его всасывается в тонком кишечнике с помощью специфического механизма активного транспорта, остальное количество расщепляется тиаминазой кишечных бактерий. С током крови всосавшийся тиамин попадает вначале в печень, где фосфорилируется тиаминпирофосфокиназой, а затем переносится в другие органы и ткани.
ТПФ-киназа
 АТФ + Tиамин Тиаминпирофосфат + АМФ
АТФ + Tиамин Тиаминпирофосфат + АМФ
Существует мнение, что основной транспортной формой тиамина является ТМФ.
|
|
|
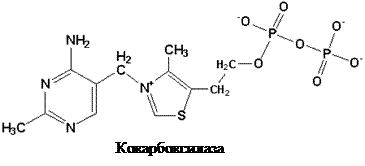
Витамин В1 присутствует в различных органах и тканях как в форме свободного тиамина, так и в форме его фосфорных эфиров: тиаминмонофосфата (ТМФ), тиаминдифосфата (ТДФ, синонимы: тиаминпирофосфат, ТПФ, кокарбоксилаз а) и тиаминтрифосфата (ТТФ).
 |
ТТФ – синтезируется в митохондриях с помощью фермента ТПФ-АТФ-фосфотранс феразы:
Трансфереза
 ТПФ + АТФ ТДФ + АМФ
ТПФ + АТФ ТДФ + АМФ
Основной коферментной формой (60–80 % от общего внутриклеточного содержания) является ТПФ.
ТТФ играет важную роль в метаболизме нервной ткани. При нарушении его образования развивается некротизирующая энцефалопатия. После распада коферментов свободный тиамин выделяется с мочой и определяется в виде тиохрома.
Биохимические функции. Витамин В1 в форме ТПФ является составной частью ферментов, катализирующих реакции прямого и окислительного декарбоксилирования кетокислот.
Участие ТПФ в реакциях декарбоксилирования кетокислот объясняется необходимостью усиления отрицательного заряда углеродного атома карбонила кетокислоты в переходном, нестабильном состоянии. Переходное состояние стабилизируется ТПФ путем делокализации отрицательного заряда карбаниона тиазолового кольца, играющего роль своеобразного электронного стока. Вследствие такого протонирования образуется активный ацетальдегид (гидроксиэтил-ТПФ).
Аминокислотные остатки белков обладают слабой способностью осуществлять то, что с легкостью делает ТПФ, поэтому апобелки нуждаются в коферменте. ТПФ жестко связан с апоферментом мультиферментных комплексов дегидрогеназ α-оксикетокислот (см. ниже).
1. Участие ТПФ в реакции прямого декарбоксилирования пировиноградной кислоты (ПВК). При декарбоксилировании ПВК с помощью пируватдекарбоксилазы образуется ацетальдегид, который под воздействием алкогольдегидрогеназы превращается в этанол.ТПФ является незаменимым кофактором пируватдекарбоксилазы. Этим ферментом богаты дрожжи.
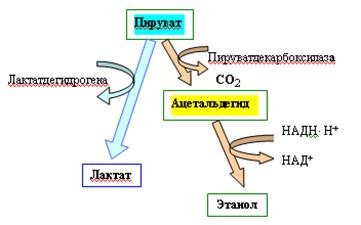
2. Участие ТПФ в реакциях окислительного декарбоксилирования. Окислительное декарбоксилирование ПВК катализирует пируватдегидрогеназа. В состав пируватдегидрогеназного комплекса входят несколько структурно связанных ферментных белков и коферментов. ТПФ катализирует начальную реакцию декарбоксилирования ПВК. Эта реакция идентична катализируемой пируватдекарбоксилазой. Однако в отличие от последней, пируватдегидрогеназа не превращает промежуточный продукт гидроксиэтил-ТПФ в ацетальдегид. Вместо этого гидроксиэтильная группа переносится к следующему ферменту в мультиферментной структуре пируватдегидрогеназного комплекса.
Окислительное декарбоксилирование ПВК является одной из ключевых реакций в обмене углеводов. В результате этой реакции ПВК, образовавшаяся при окислении глюкозы, включается в главный метаболический путь клетки – цикл Кребса, где окисляется до углекислоты и воды с выделением энергии. Таким образом, благодаря реакции окислительного декарбоксилирования ПВК создаются условия для полного окисления углеводов и утилизации всей, заключенной в них энергии. Кроме того, образующаяся при действии ПДГ-комплекса активная форма уксусной кислоты служит источником для синтеза многих биологических продуктов: жирных кислот, холестерола, стероидных гормонов, ацетоновых тел и др.
Окислительное декарбоксилирование α-кетоглутатарата катализирует α–кетоглута-ратдегидрогеназа. Этот фермент является составной частью цикла Кребса. Строение и механизм действия α-кетоглутаратдегидрогеназного комплекса схожи с пируватдегидрогеназой, т.е. ТПФ также катализирует начальный этап превращения кетокислоты. Таким образом, от степени обеспеченности клетки ТПФ зависит бесперебойная работа этого цикла.
|
|
|
Помимо окислительных превращений ПВК и α-кетоглутарата, ТПФ принимает участие в окислительном декарбоксилировании кетокислот с разветвленным углеродным скелетом (продукты дезаминирования валина, изолейцина и лейцина). Эти реакции играют важную роль в процессе утилизации аминокислот и, следовательно, белков клеткой.
3. ТПФ – кофермент транскетолазы. Транскетолаза – фермент пентозофосфатного пути окисления углеводов.Физиологическая роль этого пути заключается в том, что он является основным поставщиком НАДФH + H+ и рибозо-5-фосфата. Транскетолаза переносит двууглеродные фрагменты от ксилулозо-5-фосфата к рибозо-5-фосфату, что приводит к образованию триозофосфата (3-фосфоглицеринового альдегида) и гептозы (седогептулозо-7-фосфата). ТПФ необходим для стабилизации карбаниона, образующегося при расщеплении связи С2 - С3 ксилулозо-5-фосфата.
4. Витамин В1 принимает участие в синтезе ацетилхолина, катализируя в пируватдегидрогеназной реакции образование ацетил-КоА – субстрата ацетилирования холина.
5. Помимо участия в ферментативных реакциях, тиамин может выполнять и некоферментные функции, конкретный механизм которых еще нуждается в уточнении. Полагают, что тиамин участвует в кроветворении, на что указывает наличие врожденных тиаминзависимых анемий, поддающихся лечению высокими дозами этого витамина, а также в стероидогенезе. Последнее обстоятельство позволяет объяснить некоторые эффекты препаратов витамина В1 как опосредованных стресс-реакцией.
Гиповитаминоз. Уже ранние проявления гиповитаминоза сопровождаются снижением аппетита и тошнотой. Отмечаются неврологические расстройства, к которым относятся нарушение периферической чувствительности, ощущение ползания «мурашек», невралгии. Характерна забывчивость, особенно на недавние события. Слабость сердечной мышцы проявляется тахикардией даже при незначительных нагрузках.
Недостаток в пище тиамина приводит к значительному накоплению пировиноградной и α-кетоглутаровой кислот, снижению активности тиаминзависимых ферментов в крови и тканях организма.
|
|
|
В эксперименте показано, что тиаминовая недостаточность сопровождается нарушением структуры и функции митохондрий. Добавление к последним ТПФ нормализует тканевое дыхание. У белых крыс, лишенных таимина, развивалась анорексия, уменьшалась масса тела. Шерсть теряла свой блеск, становилась взъерошенной. Животные мало двигались и обычно лежали, свернувшись в углу клетки. Анорексия является результатом резкого угнетения секреции желудочного сока и ослаблением его переваривающей способности.
Алиментарная недостаточность тиамина у человека приводит к патологическим изменениям в нервной, сердечно-сосудистой и пищеварительной системах, сопровождаясь общим истощением организма.
Болезнь бери-бери возникает при значительном дефиците тиамина и характеризуется крайне тяжелым течением. В прошлом веке в странах Востока она унесла миллионы жизней. Бери-бери в переводе с индийского означает «овца». Походка больного, действительно, похожа на поступь овцы (симптом симметричного опускания стоп). Поскольку у заболевших отмечалась тяжесть в ногах и скованность походки, бери-бери называлась также «кандальной болезнью». Этим заболеванием часто страдали заключенные, рацион питания которых состоял в основном из очищенного риса. Проявление недостаточности тиамина можно наблюдать до сих пор у бедных лиц в тех странах, где основу питания населения составляет полированный рис – в шлифованном зерне, в отличие от неочищенного, нет этого витамина. Последняя эпидемия бери-бери была на Филиппинах в 1953 г (погибло 100 000 человек).
Болезнь имеет две формы: сухую (нервно-паралитическую) и отечную (сердечную). Причем в обоих случаях поражаются и сердечно-сосудистая и нервная системы, но в разной степени. В настоящее время классической бери-бери, по-видимому, уже нет, однако явления умеренного гиповитаминоза отмечаются часто. К основным симптомам недостаточности тиамина относятся: физическая слабость, снижение аппетита (витамин В1 необходим для стимуляции желудочной секреции), стойкие запоры; расстройство функции нервной системы (онемение пальцев, чувство «ползания мурашек», утрата периферических рефлексов, боль по ходу нервов); нарушения психической деятельности (раздражительность, забывчивость, страх, иногда галлюцинации, снижение интеллекта). Позже развивается глубокое поражение нервной системы, характеризующееся потерей чувствительности конечностей, развитием параличей, атрофией мышц в результате нарушения их иннервации. При отечной форме, наряду с явлениями полиневрита, отмечаются тахикардия и одышка даже при незначительных нагрузках. Из-за слабости сердечной мышцы развиваются отеки. Особенно часто проявления тиаминовой недостаточности наблюдаются у хронических алкоголиков вследствие их склонности больше пить, чем есть. Синдром Вернике, развивающийся у этих лиц, характеризуется нарушением координации движений, зрительной функции, спутанностью сознания.
Особая чувствительность нервной ткани к недостатку тиамина объясняется тем, что коферментная форма этого витамина абсолютно необходима нервным клеткам для усвоения глюкозы, которая является для них почти единственным источником энергии (большинство других клеток организма может использовать иные энергетические вещества, например жирные кислоты). Кстати, питание преимущественно углеводной пищей (белый хлеб, сладости) приводит к повышенной потребности в тиамине и, следовательно, к развитию вторичной тиаминовой недостаточности.
Существуют врожденные нарушения обмена тиамина, наиболее распространенным из которых является синдром Вернике-Корсакова. В основе этого синдрома, сопровождающегося потерей памяти и частичным параличом, лежит изменение свойств фермента транскетолазы, у которой уменьшается сродство к ТПФ. Гены других ТПФ-зависимых ферментов не затрагиваются. Заболевание проявляется, если уровень потребляемого ТПФ снижается ниже значений, необходимых для насыщения транскетолазы. Синдром часто встречается у хронических алкоголиков при недостаточном потреблении ими витаминов.
Гипервитаминоз не описан.Избыток принятого витамина быстро выводится с мочой, но у некоторых лиц имеется повышенная чувствительность к парэнтеральному введению препаратов тиамина.
Оценка обеспеченности организма тиамином. С этой целью обычно определяют содержание витамина и/или его коферментов в эритроцитах крови. Поскольку при недостатке витамина В1 нарушается окислительное декарбоксилирование кетокислот, увеличение содержания в крови и моче пировиноградной и α-кетоглутаровой кислот будет свидетельствовать о недостатке тиамина в организме. Однако следует иметь в виду, что накопление пирувата отмечается не только при гиповитаминозе В1, но и при гипоксии и других патологических состояниях.
Наилучшим способом судить о степени обеспеченности организма витамином В1 является определение активности тиаминзависимых ферментов. Однако активность пируват- и α–кетоглутаратдегидогеназ снижается только при глубоком гиповитаминозе, поскольку их апофермент прочно связывает ТПФ. Транскетолаза связывает ТПФ слабее, и активность ее в эритроцитах начинает снижаться уже на ранних стадиях гиповитаминоза В1. Если к образцу крови добавить ТПФ, то величина возрастания активности транскетолазы (так называемый ТПФ-эффект) позволит судить о степени недостаточности тиамина.
Суточная потребность. Пищевые источники. Довольно много витамина В1 содержится в пшеничном хлебе из муки грубого помола, в оболочке семян хлебных злаков, в сое, фасоли, горохе. Много его в дрожжах. Меньше – в картофеле, моркови, капусте. Из продуктов животного происхождения наиболее богаты тиамином печень, нежирная свинина, почки, мозг, яичный желток. В настоящее время дефицит витамина В1 становится одной из проблем питания, так как из-за высокого потребления сахара и кондитерских изделий, а также белого хлеба и шлифованного риса существенно увеличивается расход этого витамина в организме. Использовать дрожжи в качестве источника витамина не рекомендуется из-за высокого содержания в них пуринов, что может приводить к возникновению обменного артрита (подагры).
Суточная потребность в тиамине – 1,1 –1,5 мг.
Витамин В2 (рибофлавин)
Химическое строение и свойства. Витамин В2 отличается от других витаминов желтым цветом (flavus – желтый). Однако в отличие от окисленной желтой, восстановленная форма витамина бесцветная.
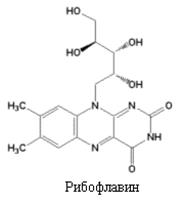
Рибофлавин впервые был выделен из кисломолочной сыворотки. Синтезирован Р. Куном в 1935 г. Молекула рибофлавина состоит из гетероциклического изоаллоксазинового ядра, к которому присоединен в 9 положении спирт рибитол (производное D -рибозы). Термином “флавины” обозначаются многие производные изоаллоксазина, обладающие В2 -витаминной активностью.
Биосинтез флавинов осуществляется растительными и многими бактериальными клетками, а также плесневыми грибками и дрожжами. Благодаря микробному биосинтезу рибофлавина в желудочно-кишечном тракте жвачные животные не нуждаются в этом витамине. У других животных и человека синтезирующихся в кишечнике флавинов недостаточно для предупреждения гиповитаминоза.
Витамин В2 хорошо растворим в воде, устойчив в кислой среде, но легко разрушается в нейтральной и щелочной, а также под действием видимого и УФ-облучения.
Метаболизм. В пище витамин В2 находится преимущественно в составе своих коферментных форм, связанных с белками, – флавопротеинов. Под влиянием пищеварительных ферментов витамин высвобождается и всасывается путем простой диффузии в тонком кишечнике. В энтероцитах рибофлавин фосфорилируется до ФМН (флавин-мононуклеотида) и ФАД (флавин-аденин-динуклеотида). Реакции протекают следующим образом:
 АТФ Флавокиназа AДФ
АТФ Флавокиназа AДФ
Рибофлавин Рибофлавин-5-фосфат (ФМН)
ФМН связывается с аденозинмонофосфатом при участии фермента пирофосфорилазы.
ATФ ФФн
 Пирофосфорилаза
Пирофосфорилаза
ФМН ФАД
Аналогичные реакции протекают в клетках крови, печени и других тканей.
Биохимические функции. Основное значение витамина В2 состоит в том, что он входит в состав флавиновых коферментов – ФМН и ФАД. Роль этих коферментов заключается в следующем:
1. ФМН и ФАД – коферменты оксидаз, переносящих электроны и Н+ с окисляемого субстрата на кислород. Таковыми являются ферменты, участвующие в распаде аминокислот (оксидазы D - и L -аминокислот), нуклеотидов (ксантиноксидаза), биогенных аминов (моно- и диаминоксидазы) и др.
2. ФМН и ФАД – промежуточные переносчики электронов и протонов в дыхательной цепи: ФМН входит в состав I-го коплекса цепи тканевого дыхания, ФАД – в состав II-го комплекса.
3. ФАД – кофермент пируват- и α-кетоглутаратдегидрогеназных комплексов (наряду с ТПФ и другими коферментами ФАД осуществляет окислительное декарбоксилирование соответствующих кетокислот), а также единственный кофермент сукцинатдегидрогеназы (фермента цикла Кребса).
4. ФАД – участник реакций окисления жирных кислот в митохондриях (он является коферментом ацил-КоА-дегидрогеназы).
Гиповитаминоз. Недостаток витамина В2, как и других витаминов, проявляется слабостью, повышенной утомляемостью и склонностью к простудным заболеваниям. К специфическим проявлениям недостаточности рибофлавина относятся воспалительные процессы в слизистых оболочках. Слизистая губ и полости рта становится сухой, язык приобретает ярко-красный цвет, в углу рта появляются трещины. Отмечается повышенное шелушение эпителия кожи, особенно на лице. Конъюнктива глаза теряет блеск из-за сухости, вызываемой закупоркой слезного канала слущивающимся эпителием. Роговица прорастает сосудами (компенсаторная реакция на недостаточность дыхательной функции роговицы) и затем мутнеет. Отмечается катаракта (помутнение хрусталика).
Гипервитаминоз не описан. При введении больших доз витамина В2 избыточного накопления флавинов в тканях не происходит, так как рибофлавин быстро выделяется с мочой.
Оценка обеспеченности организма рибофлавином. Содержание витамина В2 в крови остается в пределах нормы даже при выраженном гиповитаминозе. Смерть наступает еще при достаточном уровне витамина в тканях (30 % от общего количества). О степени тяжести гиповитаминоза следует судить по уровню в тканях его коферментных форм, методы определения которых достаточно трудоемки.
Суточная потребность. Пищевые источники. Суточная потребность в витамине – 1-3 мг.
Основными источниками рибофлавина являются печень, почки, желток куриного яйца, творог. В кислом молоке витамина содержится больше, чем в свежем. В растительных продуктах витамина В2 мало (исключение – миндальные орехи). Частично дефицит рибофлавина восполняется кишечной микрофлорой.
Хронический недостаток рибофлавина в питании существенно увеличивает риск развития рака пищевода и других органов.
Витамин В3 (пантотеновая кислота)
Химическое строение и свойства. Витамин В3 широко распространен в природе, отсюда и его название – пантотеновая кислота (от panthos - повсюду). Витамин открыт Р. Вильямсом в 1933 г., спустя десятилетие он уже был синтезирован химическим путем.
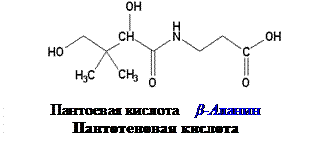
Пантотеновая кислота (пантоил-β-аланин) – светло-желтая маслянистая жидкость, хорошо растворимая в воде и этаноле. Спиртовое производное пантотеновой кислоты – пантенол – эффективно всасывается не только при энтеральном введении, но и при накожном его нанесении, в связи с чем пантенол получил широкое применение в дерматологии.
Метаболизм. Всасываясь на всем протяжении тонкого кишечника и в толстой кишке, в зависимости от концентрации путем простой диффузии или активного транспорта, пантотеновая кислота с током крови поступает в ткани.
Коферментными формами витамина В3, образующимися в цитоплазме клеток, являются: 4′-фосфопантетеин, дефосфо-КоА и КоА-SH.
Биохимические функции. Значение пантотеновой кислоты определяется исключительно важной ролью ее коферментных форм в ключевых реакциях метаболизма, а также способностью производных витамина, таких как, S-сульфопантетеин, поддерживать рост бифидобактерий – важного компонента биоценоза кишечника.
Фосфопантетеин является активной субъединицей АПБ (ацил-переносящего белка) синтазы жирных кислот – представителя класса так называемых фосфопантетеинпротеинов.
Дефосфо-КоА – кофермент цитратлиазы и N-ацетилтрансферазы.
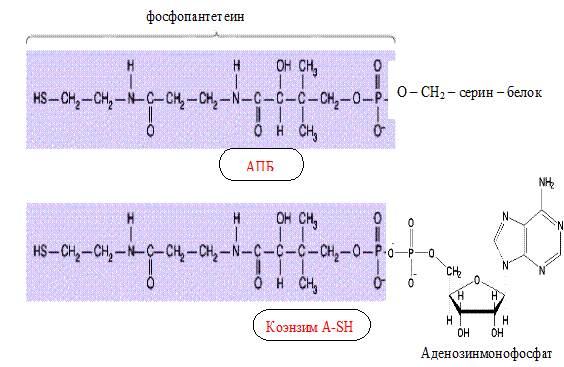
КоА-SH – главный кофермент клетки, с участием которого протекают многочисленные реакции метаболизма.
· Активирование ацетата (образование ацетил-КоА – СН3-СО~S-KoA). Ацетил-КоА является субстратом для синтеза жирных кислот, холестерина и стероидных гормонов, ацетоновых тел, ацетилхолина, ацетилглюкозаминов. С него начинаются реакции главного метаболического пути клетки - цикла Кребса. Ацетил-КоА принимает участие в реакциях обезвреживания (ацетилирование биогенных аминов и чужеродных соединений).
· Активирование жирных кислот (образование ацил-КоА). Ацил-КоА используется для синтеза липидов, окисляясь, он служит также источником энергии.
· Транспорт жирных кислот в митохондрии.
· Окислительное декарбоксилирование кетокислот – пировиноградной (при этом образуется ацетил-КоА)и α–кетоглутаровой (при этом образуется сукцинил-КоА, используемый в реакциях синтеза гема гемоглобина и простетической группы цитохромов).
Гиповитаминоз. Недостаточность пантотеновой кислоты практически не встречается, так как она синтезируется микрофлорой кишечника. При назначении добровольцам антивитамина проявления недостаточности пантотеновой кислоты характеризовались психоэмоциональной неустойчивостью, склонностью к обморокам, изменением походки, парастезиями, чувством жжения стоп. Синдром «жжения стоп», широко распространенный во время Второй мировой войны у военнопленных японских лагерей, хорошо излечивался назначением пантотената кальция.
Вторичная недостаточность витамина развивается при многих хронических заболеваниях, длительном применении диуретиков и алкоголизме.
Гипервитаминоз не описан, равно, как токсические проявления после введения препаратов витамина.
Оценка обеспеченности организма пантотеновой кислотой. Для этой цели применяются микробиологический и хроматографический методы определения содержания пантотеновой кислоты и ее производных. в крови и моче. Используется также косвенная оценка степени обеспеченности витамином В3 по количеству ацетилированной тест-дозы ароматического амина (сульфаниламида).
Суточная потребность. Пищевые источники. Пантотеновая кислота широко распространена в продуктах растительного и животного происхождения. Особенно высоко содержание витамина в пчелином маточном молочке и пивных дрожжах. Достаточно много его в печени животных, яичном желтке, гречихе, овсе, бобовых.
Суточная потребность – 10– 15 мг.
Витамин РР (витамин В5, никотиновая кислота, никотинамид, ниацин). Антипеллагрический витамин
Химическое строение и свойства. Витамин РР был выделен К. Эвельгеймом в 1937г., его введение предохраняло от заболевания пеллагрой или излечивало ее. «РР» означает п ротиво п еллагрический (preventive pellagra).
Никотиновая кислота является пиридин-3-карбоновой кислотой, никотинамид –ее амидом. Оба соединения в организме легко превращаются друг в друга и поэтому обладают одинаковой витаминной активностью.
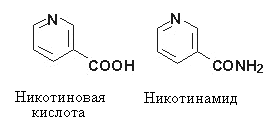
Витамин РР плохо растворяется в воде, но хорошо – в водных растворах щелочей.
Метаболизм. Поступающий с пищей витамин РР быстро всасывается в желудке и кишечнике в основном путем простой диффузии. С током крови никотиновая кислота легко попадает в печень и другие органы, несколько медленнее проникает в них никотинамид. В тканях оба соединения преимущественно используются для синтеза коферментных форм – НАД и НАДФ. Коферменты через биомембраны не проникают.
Биохимические функции. Почти весь имеющийся в клетках и жидких средах организма витамин РР представлен в виде никотинамида, включенного в состав коферментов – НАД и НАДФ. Поэтому значение ниацина определяется ролью этих коферментов, которая является чрезвычайно многогранной:
1. НАД - кофермент дегидрогеназ, участвующих в реакциях окисления глюкозы, жирных кислот, глицерола, аминокислот; является коферментом дегидрогеназ цикла Кребса (исключая сукцинатдегидрогеназу). В этих реакциях кофермент выполняет функцию промежуточного акцептора электронов и протонов.
2. НАД – переносчик протонов и электронов в дыхательной цепи митохондрий (от окисляемого субстрата к первому комплексу цепи тканевого дыхания).
3. НАД – субстрат ДНК-лигазной реакции при синтезе и репарации ДНК, а также субстрат для синтеза поли-АДФ-рибозы в поли-(АДФ)-рибозилировании белков хроматина.
4. НАДФН – донор водорода в реакциях синтеза жирных кислот, холестерина, стероидных гормонов и некоторых других соединений.
5. НАДФН – компонент монооксигеназной цепи микросомного окисления, выполняющей функцию детоксикации антибиотиков и других чужеродных веществ.
6. НАД и НАДФ – аллостерические регуляторы ферментов энергетического обмена, в частности, ферментов цикла Кребса, а также реакций новообразования глюкозы (глюконеогенеза).
Никотинамид и N-метилникотинамид (метаболит никотинамида) являются участниками процесса метилирования т-РНК и белков.
Гиповитаминоз. Характерным признаком недостаточности ниацина является симптомокомплекс “трех Д”: дерматит, диарея, деменция. Так проявляется заболевание пеллагрой (от итал. pelle agra –шершавая кожа). Болезнь, свирепствовавшая в Испании и Португалии в XVI в., быстро распространилась по странам Средиземноморского побережья после того, как там стали интенсивно возделывать кукурузу. Поскольку кукуруза намного продуктивнее, чем прочие зерновые культуры, она завоевала огромную популярность и постепенно стала основным продуктом питания для бедных слоев населения. Однако в кукурузе витамин РР содержится в трудноусвояемой для человека форме, она бедна триптофаном, из которого способен синтезироваться этот витамин..
В основе заболевания лежит нарушение пролиферативной активности и энергетики клеток.
Дерматит чаще всего отмечается на открытых участках кожи, которая под действием солнечных лучей краснеет, покрывается пигментными пятнами (в виде крыльев бабочки) и шелушится. Язык становится ярко-красным и болезненным, утолщается, на нем появляются трещины (глоссит). Слизистые оболочки полости рта (стоматит, гингивит) и кишечника воспаляются, затем изъязвляются. Расстройство пищеварения проявляется тошнотой, отсутствием аппетита, болями в животе, поносами. Нарушается функция периферических нервов и центральной нервной системы. Появляется головокружение, головные боли. Апатия сменяется депрессией. Тугодумие – вплоть до умственной отсталости – тоже проявление болезни. Развиваются психозы, психоневрозы, в тяжелых случаях отмечаются галлюцинации.
Симптомы пеллагры чаще всего наблюдаются у лиц с недостатком белка в диете. Объясняется это тем, что животные белки содержат оптимальное количество аминокислоты триптофана, витамина В6 и некоторых других, необходимых для биосинтеза ниацина.
Гипервитаминоз. У млекопитающих состояния гипервитаминоза РР вызвать не удалось. Данные о способности ниацина накапливаться в тканях отсутствуют. Избыток никотиновой кислоты быстро выводится с мочой.
Оценка обеспеченности организма витамином РР. Обеспеченность организма ниацином достаточно хорошо характеризуется величиной экскреции основных продуктов его катаболизма – N-метилникотинамида и метил-2-пиридон-5-карбоксиамида. В нормальных физиологических условиях концентрация выводимых с мочой метаболитов никотиновой кислоты и никотинамида невелика, но резко возрастает при их избыточном поступлении в организм. Определение количественного содержания N-метилникотинамида и его пиридонов в моче после применения нагрузочных доз витамина РР до настоящего времени служит единственным критерием обеспеченности организма этим витамином. Таким критерием не могут быть уровни самого витамина РР или его коферментных форм в крови, так как даже при тяжелой пеллагре их содержание мало отличается от содержания у здоровых лиц.
Суточная потребность. Пищевые источники. Суточная потребность составляет 20–25 мг. Источником витамина являются животные (особенно печень, мясо) и многие растительные продукты, в первую очередь, рис, хлеб, картофель. Молоко и яйцо содержат следы ниацина. Правда, витамин РР способен синтезироваться клетками организма из триптофана, но этот процесс малоэффективен – из десятков молекул триптофана образуется только одна молекула витамина. Тем не менее продукты, богатые этой аминокислотой (молоко и яйцо) могут компенсировать недостаточное поступление никотинамида с пищей.
Витамин В6 (пиридоксин). Антидерматитный витамин
Химическое строение и свойства. Витамин В6 включает в себя группу трех природных производных пиридина, обладающих одинаковой витаминной активностью: пиридоксина, пиридоксаля, пиридоксамина, отличающихся друг от друга наличием спиртовой, альдегидной или аминогруппы. Витамин В6 был открыт в 1934 г.Н.Сент-Дьерди и вскоре синтезирован химически.
Пиридоксин хорошо растворяется в воде и этаноле, устойчив в кислой и щелочной средах, но легко разрушается под действием света при рН=7,0.
Метаболизм. Всосавшись в тонком кишечнике, все формы витамина B6 током крови разносятся к тканям и, проникая в клетки, фосфорилируются с участием АТФ и пиридоксалькиназ. Коферментные функции выполняют 2 фосфорилированных производных пиридоксина: придоксальфосфат и пиридоксаминфосфат.
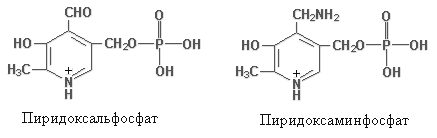
Распад коферментов осуществляется путем дефосфорилирования и окисления в тканях. Основным продуктом катаболизма является 4-пиридоксиловая кислота, которая экскретируется с мочой.
Биохимические функции. Витамин В6 часто называют «королем обмена аминокислот; вместе с тем его коферментные формы участвуют в реакциях, катализируемых почти всеми классами ферментов. Механизм действия всех пиридоксальфосфат-зависимых ферментов сходен: 1) вначале образуются шиффовы основания между аминокислотой и коферментом, при этом нитрофильный азот пиридинового кольца действует как своеобразный электронный сток, уводя электроны от аминокислоты и стабилизируя промежуточный интермедиат – карбанион; 2) будучи неустойчивыми, шиффовы основания (альдимины) далее модифицируются в процессах трансаминирования, декарбоксилирования, изомеризации и многих других превращениях боковой цепи аминокислот.
Коферментные формы витамина В6 входят в состав следующих ферментов:
1. Аминотрансфераз аминокислот, катализирующих обратимый перенос NH2-
группы от аминокислоты на α-кетокислоту. В этой реакции образуются новые α-кетокислоты и заменимые аминокислоты.
2. Декарбоксилаз аминокислот, отщепляющих карбоксильную группу аминокислот, что приводит к образованию биогенных аминов (гистамина, серотонина, ГАМК и др.), а также моноаминоксидаз, гистаминазы (диаминооксидаза) и аминотрансферазы ГАМК, обезвреживающих (окисляющих) биогенные амины.
3. Изомераз аминокислот, с помощью которых организм разрушает D -аминокислоты (в состав тканевых белков млекопитающих входят L -аминокислоты).
4. Аминотрансфераз иодтирозинов и иодтиронинов, участвующих в синтезе гормонов щитовидной железы и распаде этих гормонов в периферических тканях.
5. Синтазы δ–аминолевуленовой кислоты, участвующей в биосинтезе гема гемоглобина и других гем-содержащих белков (из глицина и сукцинил~ КоА).
6. Кинурениназы и кинуренинаминотрансферазы, обеспечивающих синтез витамина РР из триптофана.
7. Цистатионинсинтазы (а) и цистатионинлиазы (б) – ферментов, катализирующих синтез и распад цистатионина.
8. Синтетазы 3-кетодигидросфингозида, участвующей в реакциях биосинтеза сфинголипидов (из серина и пальмитил~ КоА).
Таким образом, витамин В6 характеризуется исключительно широким спектром биологического действия. Он принимает участие в регуляции белкового, углеводного и липидного обмена, биосинтезе гема и биогенных аминов, гормонов щитовидной железы и других биологически активных соединений. Помимо каталитического действия, пиридоксальфосфат участвует в процессе активного транспорта некоторых аминокислот через клеточные мембраны; ему присуща функция регулятора конформационного состояния гликогенфосфорилазы – главного регулируемого фермента, осуществляющего распад гликогена.
Гиповитаминоз. Основными проявлениями недостаточности витамина В6 являются гипохромная анемия и судороги. Отмечается развитие сухого себорейного дерматита, стоматита и глоссита. Чаще всего пиридоксиновая недостаточность наблюдается у маленьких детей при искусственном вскармливании стерилизованным молоком (разрушается витамин В6), у беременных при токсикозах, а также у взрослых при длительном лечении противотуберкулезным препаратом изониазидом (антагонист пиридоксаля). Повышенная возбудимость и склонность к судорогам объясняются недостаточным образованием ГАМК (γ-аминомасляной кислоты) – медиатора торможения нейронов. Поражения кожи частично обусловлены недостаточностью витамина РР, в синтезе которого принимает участие витамин В6. По данным клинических наблюдений, дефицит пиридоксаля предрасполагает к инфаркту миокарда.
Известно несколько болезней, связанных сврожденными нарушениями обмена пиридоксина. Наиболее типичными являются гомоцистинурия, пиридоксинзависимый судорожный синдром и анемия.
Гомоцистинурия. При этом заболевании имеется недостаточность цистатионинсинтазы – витамин В6-зависимого фермента, катализирующего конденсацию гомоцистеина и серина с образованием цистатионина (при других формах гомоцистинурии страдают другие ферменты, участвующие в обмене гомоцистеина). В крови и тканях больных накапливаются аминокислоты гомоцистеин и метионин (предшественник гомоцистеина), первая легко экскретируется почками в виде своей окисленной формы – гомоцистина. Обнаружение гомоцистеина в крови и гомоцистина в моче служит диагностическим тестом на гомоцистинурию.
Заболевание обнаруживается у детей или подростков, проявляясь своеобразным симптомокомплексом: эктопией хрусталика (иногда подвывих хрусталика является единственным начальным симптомом заболевания); генерализованным остеопорозом и деформациями скелета (у ребенка – “паучьи” конечности, т.е. длинные и тонкие, наблюдается искривление позвоночника, а также плоскостопие, неправильный прикус зубов); своеобразной походкой (негнущаяся походка из-за дефекта зрения и костных аномалий); замедлением физического развития (начинают ходить с 1,5–2 лет). Дети с гомоцистинурией, как правило, светловолосы и голубоглазы (нарушение пигментации). Задержка умственного развития наблюдается не всегда. Основной причиной гибели больных является тромбоз артерий или вен; тромбообразование может происходить в различных участках тела.
Лечение заключается в длительном назначении высоких доз пиридоксина – до 0,5–1,0 г в сутки.
Пиридоксинзависимая анемия. Анемия, возникающая при недостатке витамина В6, является гипохромной (показатель гематокрита и содержание гемоглобина низки), микроцитарной (форма эритроцитов изменена, продолжительность их жизни укорочена), сидеробластической (железо накапливается в эритробластах костного мозга и внутренних органах). Концентрация железа в плазме крови повышена. Анемия не поддается лечению другими витаминами.
Развитие гипохромной анемии объясняется нарушением биосинтеза гема вследствие низкой активности синтетазы δ-аминолевулиновой кислоты, коферментом которой является фосфопиридоксаль. Из-за нарушения образования гема снижается и содержание гемоглобина в эритроцитах, а неутилизируемое железо откладывается в тканях. Роль витамина В6 в кроветворении, скорее всего, не ограничивается только этой его способностью.
Гипервитаминоз. Какого-либо выраженного побочного действия при длительном приеме высоких доз витамина (10–20 раз превышающих суточную потребность) отмечено не было. Доза 200–5000 мг может вызвать онемение, покалывание и кратковременную потерю чувствительности в конечностях.
Оценка обеспеченности организма пиридоксином. Наиболее популярным методом оценки обеспеченности организма витамином В6 является флуориметрическое определение содержания в моче 4-пиридоксиловой кислоты – продукта деградации витамина. При гиповитаминозе В6 суточная экскреция 4-пиридоксиловой кислоты снижается (в норме – 3–5 мг). Однако более точную информацию дает измерение содержания самого витамина (особенно пиридоксальфосфата) в плазме крови и моче.
Суточная потребность. Пищевые источники. Витамином В6 богаты бобовые, зерновые культуры, мясные продукты, рыба, картофель. Он синтезируется кишечной микрофлорой, частично покрывая потребность организма в этом витамине.
В сутки человек должен получать 2–2,2 мг пиридоксина. Потребность в витамине возрастает при увеличении количества белка в рационе, а также во время беременности и лактации. Прием алкоголя и курение уменьшают содержание пиридоксальфосфата в тканях.
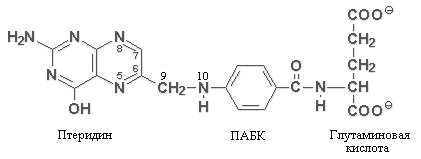
Фолиевая кислота (Фолацин. Витамин В9. Витамин Вс).
Химическое строение и свойства. Витамин обнаружили в 1930 г., когда было показано, что люди с определенным типом мегалобластической анемии могли быть излечены принятием в пищу дрожжей или экстракта печени. В 1941 г. фолиевая кислота была выделена из зеленых листьев (от лат. folium – лист, отсюда и название витамина). Витамином ВС это соединение назвали из-за его способности излечивать анемию у цыплят (от англ. сhicken –цыпленок).
Витамин состоит из трех компонентов: гетероциклического остатка птеридина, парааминобензойной кислоты (ПАБК), которая может самостоятельно регулировать рост многих бактерий, и глутаминовой кислоты (несколько остатков). В организме человека птеридиновое кольцо не синтезируется, поэтому удовлетворение потребности в фолацине полностью зависит от его поступления с пищей.
 2015-06-26
2015-06-26 1853
1853