У 1911 р. Нільс Бор (датський фізик, 1885 – 1962рр.) одержав ступінь доктора, переїхав в Англію і продовжував працювати під керівництвом Томсона і Резерфорда.
Спроби теоретично обґрунтувати спектральні закономірності атома водню привели Бора в 1913 р. до нової теорії водню, в основу якої була покладена планетарна модель атома Резерфорда і яка була доповнена трьома постулатами Бора, що суперечили законам класичної фізики. Із цього приводу цікавий вислів американського фізика Леона Купера, який сказав: «Звичайно, було самовпевнено висувати пропозиції, що суперечать електродинаміці Максвела і механіці Ньютона, але Бор був молодий».
Висунуті Бором постулати полягали в наступному:
1) Постулат стаціонарних орбіт стверджує, що в атомі відбуваються рухи електрона по деяких стаціонарних орбітах без випромінювання (всупереч електродинаміці).
2) По другому постулату такими стаціонарними орбітами будуть ті, для яких момент кількості руху електрона кратний величині постійної Планка
|
|
|
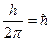 , де h = 6,63 · 10 –34 Дж · сек
, де h = 6,63 · 10 –34 Дж · сек
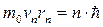 (2.21)
(2.21)
п – ціле число, що називають квантовим числом (п =1,2,3,…)
3) Третій постулат говорить про те, що під час переходу атома з одного енергетичного стану Е п в інший Е m (Е п > Е m ) випромінюється квант енергії hυ, з частотою переходу:
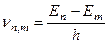 (2.22),
(2.22),
де п > (т+1), а Е п та Е m - стаціонарні значення енергії.
Поглинання атомом кванта світла з енергією hυ супроводжується його переходом із стану Е m в Е п .
Е п = Е m + hn m п (2.23)
Розглянемо тепер елементарну теорію атома водню по Бору. Умова механічної стійкості електрона у планетарній моделі має вигляд:
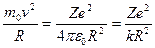 , або
, або 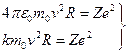 (2.24)
(2.24)
Це рівняння, разом з рівнянням другого постулату Бору, дозволяє визначити радіус орбіти rn , відповідної значенню квантового числа, рівного n і швидкість (другий постулат 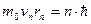 )
)
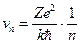 , (2.25)
, (2.25)
де k=4π ε0
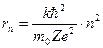 (2.26)
(2.26)
Тоді вираз (2.18) 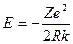 для повної енергії електрона на орбіті з урахуванням(2.26) має вигляд:
для повної енергії електрона на орбіті з урахуванням(2.26) має вигляд:
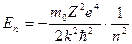 (2.27)
(2.27)
Тепер використовуємо третій постулат Бору (hn m п = Е п - Е m )з урахуванням (2.27), одержимо енергії випромінюваних атомом квантів під час переходу електрона з одного рівня (верхнього) Е п на інший (нижній) Е m
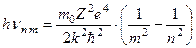 , h > (m+1) (2.28)
, h > (m+1) (2.28)
звідси для хвилевих чисел 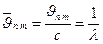 знайдемо:
знайдемо:
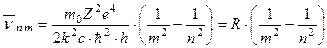
(2.29)
Тобто
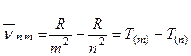
З іншого боку згідно третього постулату Бору:
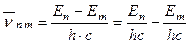
отже:
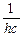
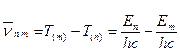 , тобто
, тобто 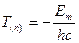
Терм Т(n) пов'язаний з енергією стаціонарного стану атома, відрізняючись від неї тільки множником
З (2.29) видно, що при m =2 одержуємо серію Бальмера 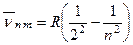 n = 3, 4...
n = 3, 4...
Для водню величина R (2.29) через значення m, e, c, h, буде рівна:
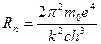 = 109737,43 см -1, по Бору
= 109737,43 см -1, по Бору
Rточне = 109677,76 см -1
Але по формулі (2.29) теорія Бора дає і інші серії: Лаймана (m =1), Пашена (m =3) і т.д.
Вираз для повної енергії електрона на n - ній квантовій орбіті дозволяє обчислити енергії атома, відповідні різним квантовим числам n і побудувати діаграму енергетичних рівнів атома водню. Рівень з найменшим значенням енергії (n =1) приймають за нульовий.
|
|
|
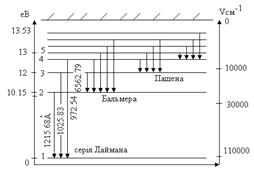
Стрілками на діаграмі показані переходи, відповідні випусканню фотонів різних спектральних серій.
По формулі (2.27) 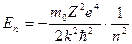 можна обчислити потенціал іонізації атома водню (z = 1), коли відбувається відрив електрона від атома. Робота іонізації
можна обчислити потенціал іонізації атома водню (z = 1), коли відбувається відрив електрона від атома. Робота іонізації 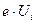 рівна різниці двох енергій Е ∞ и Е1. Тоді по (2.27)
рівна різниці двох енергій Е ∞ и Е1. Тоді по (2.27) 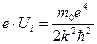 і
і 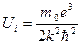 (2.30)
(2.30)
 2015-06-28
2015-06-28 2070
2070








