Лекция 4
ТЕРМОДИНАМИКА
5.1. Статистический смысл второго начала термодинамики
5.2. Энтропия и вероятность
5.3. Термодинамическая шкала температур
5.4. Некоторые применения энтропии
5.5. Термодинамические потенциалы
Статистический смысл второго начала термодинамики
До сих пор мы рассматривали второй закон термодинамики пользуясь термодинамическим методом исследования и не интересовались внутренним строением тел. Однако существует связь второго закона термодинамики с молекулярно-кинетической теорией строения вещества.
Состояние термодинамической системы может быть задано значением ее параметров – температуры, давления, объёма, внутренней энергии и т.п., характеризующих систему как целое. Это макросостояние системы.
Если состояние макроскопического тела задано столь подробно, что известны состояния всех образующих тело молекул, то такое состояние называется микросостоянием.
Любое макросостояние может быть задано разными способами, каждому из которых соответствует некоторое микросостояние. Число различных микросостояний, соответствующих данному макросостоянию, называется термодинамической вероятностью или статистическим весом макросостояния. Таким образом, термодинамическая вероятность – это число способов, которыми может быть осуществлено данное макросостояние.
|
|
|
X 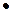 1
X 1
X 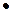 2
А А 2
А А
| X 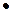 3
В В 3
В В
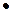  4 4
|
Некоторое представление о статистическом весе можно получить, рассмотрев способы, которыми молекулы могут быть распределены между двумя половинками сосуда с газом.
Возьмем случай, когда в сосуде, разделенном на две одинаковые половины А и В (рис.1), находится число молекул N= 4. Перенумеруем их: 1,2,3.4.
Каждая молекула с равной вероятностью может находиться как в половине А, так и в половине В. Значит, вероятность того, что любая молекула окажется в половине А, равна ½. Пребывание в половине А одной молекулы и одновременно другой – события статистически независимые. Поэтому вероятность одновременного пребывания в половине А двух молекул равна произведению вероятностей, т.е. 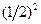 , трех молекул -
, трех молекул - 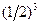 , четырех -
, четырех - 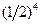 .
.
Подобные рассуждения приводят к выводу, что вероятность любого размещения четырех молекул равна 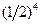 .
.
Каждое размещение - это некоторое микросостояние системы, и вероятность Р каждого из них одинакова и равна 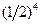 .
.
Например, макросостояние, соответствующее трем молекулам слева и одной справа может быть осуществлено одним из следующих микросостояний:
слева справа
№ 1,2,3 № 4
№ 2,3,4 № 1
№ 1,3,4 № 2
№ 1,2,4 № 3,
то есть четырьмя способами.
 Статистический вес этого макросостояния равен 4. Все 4 микросостояния равновероятны. Вероятность каждого микросостояния
Статистический вес этого макросостояния равен 4. Все 4 микросостояния равновероятны. Вероятность каждого микросостояния 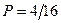 .
.
|
|
|
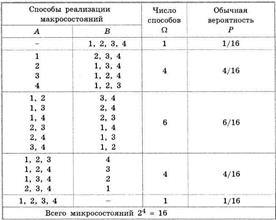
Все возможные распределения молекул по половинкам А И В сосуда приведены в таблице. В ней указаны какие возможны «макросостояния» и сколькими способами (микросостояниями) реализуется каждое «макросостояние».
Макросостояние, у которого в обеих половинах сосуда находится одинаковое число молекул (по две), реализуется с помощью шести микросостояний, т.е. статистический вес (а также вероятность) такого макросостояния состояния максимальны.
Пусть первоначально все четыре молекулы находились в половине сосуда А. С течением времени некоторые из молекул, двигаясь беспорядочно, окажутся в половине В. Это будет означать, что газ расширился. В дальнейшем макросостояние системы будет меняться случайным образом, но чаще будет осуществляться то из них, вероятность которого больше, т.е. состояние с максимальным статистичским весом 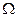 . Может произойти так, что случайно все четыре молекулы снова окажутся в половине А сосуда (газ самопроизвольно сжался), т.е. процесс расширения оказывается обратимым.
. Может произойти так, что случайно все четыре молекулы снова окажутся в половине А сосуда (газ самопроизвольно сжался), т.е. процесс расширения оказывается обратимым.
Вследствие статистической независимости поведения молекул идеального газа вероятность любого макросостояния равна произведению вероятностей пребывания молекулы в любой половине сосуда.
Для N частиц это произведение 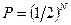 , и полное число микросостояний системы равно
, и полное число микросостояний системы равно 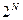 .
.
С ростом N вероятность самопроизвольного сжатия газа в одной половине резко уменьшается. Вместе с тем статистический вес (и вероятность) макросостояния, при котором молекулы распределяются равномерно по обеим половинам сосуда, стремительно растет с ростом N.
Таким образом, предоставленная самой себе макросистема стремится переходить от менее вероятных состояний к более вероятным. В этом суть необратимости. В принципе обратимый процесс возможен, но его вероятность ничтожно мала.
Таким образом, второе начало термодинамики, указывающее на необратимость перехода работы в тепло, обусловлено тем, что переход теплоты в работу означает переход от более вероятного к менее вероятному.
Понятие необратимости процессов имеет смысл только для макросистем. К совокупности небольшого числа частиц этот понятие не применимо
Рассмотрим макросостояние, при котором
в первой половине сосуда находится п молекул, а в другой N-n.
Найдем число микросостояний (способов), которыми может быть реализовано такое макросостояние. Это число равно числу перестановок N молекул, т.е. N!. Однако перестановки, при которых изменяется только порядок размещения в первой половине (п!) не приводит к новому микросостоянию. Каждому из возможных распределений отдельных молекул во второй половине сосуда соответствует п! различных размещений молекул в первой половине. Поэтому, разделив полное число перестановок N! на п!, мы исключим перестановки, которые различаются лишь способом размещения молекул в первой половине сосуда. Разделив затем это выражение на (N-n)!, мы исключим перестановки во второй половине сосуда.
В результате число распределений молекул по обеим половинам сосуда, отличающихся лишь номерами молекул в обеих половинах, равно
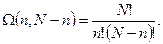
Это число микросостояний, соответствующих макросостоянию (n, N - n), т.е. статистический вес данного макросостояния.
При наиболее вероятном распределении 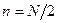
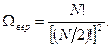
Соответствующая вероятность 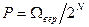 .
.
 2015-06-28
2015-06-28 6051
6051