Представим себе смесь бензина и кислорода. Реакция между этими двумя веществами с термодинамической точки зрения возможна, но она не пойдет без затраты некоторого количества энергии, поступившей, например, в форме простой искры. Так же обстоит дело и со спичкой. Содержащиеся в спичечной головке вещества могут вступить в реакцию, суммарным итогом которой будет выделение энергии, но чтобы запустить реакцию, придется сначала затратить небольшое количество энергии (достаточно тепловой энергии, выделяющейся, когда мы чиркаем спичкой о коробок). Энергия, необходимая для того, чтобы заставить вещества вступить в реакцию, называется энергией активации. Ферменты, действуя как катализаторы, снижают энергию активации (рис.). Они повышают общую скорость реакции, не изменяя в сколько-нибудь значительной степени температуру, при которой эта реакция протекает.
 Механизм действия ферментов
Механизм действия ферментов
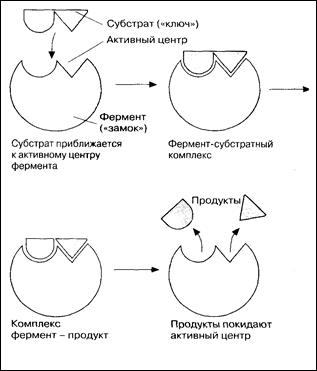
Ферменты обладают очень высокой специфичностью. Фишер (Fischer) в 1890 г. высказал предположение, что эта специфичность обусловливается особой формой молекулы фермента, точно соответствующей форме молекулы субстрата (или субстратов). Эту гипотезу часто называют гипотезой «ключа и замка»: субстрат сравнивается в ней с «ключом», который точно подходит по форме к «замку», т. е. к ферменту. В схематическом виде это представлено на рис. Часть молекулы фермента, вступающую в контакт с субстратом, называют активным центром фермента, и именно активный центр фермента имеет особую форму.
|
|
|
Образовавшиеся продукты по форме уже не соответствуют активному центру фермента. Они отделяются от него (поступают в окружающую среду), после чего освободившийся активный центрможет принимать новые молекулы субстрата.
В 1959 г. Кошланд (Koshland) предложил новую интерпретацию гипотезы «ключа и замка», получившую название гипотезы «индуцированного соответствия». На основе данных, позволяющих считать ферменты и их активные центры физически более гибкими, чем это казалось вначале, он заключил, что субстрат, соединяясь с ферментом, вызывает какие-то изменения в структуре его активного центра. Аминокислотные остатки, составляющие активный центр фермента, принимают определенную форму, которая дает возможность ферменту наиболее эффективным образом выполнять свою функцию. Подходящей аналогией в этом случае может служить перчатка, которая при надевании на руку соответствующим образом изменяет свою форму.
 Скорость ферментативных реакций
Скорость ферментативных реакций
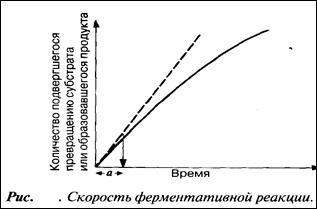
Мерой скорости ферментативных реакций служит количество субстрата, подвергшегося превращению в единицу времени, или количество образовавшегося продукта.
|
|
|
Скорость определяют по углу наклона касательной к кривой на начальной стадии (а на рис.) реакции. Чем круче наклон, тем больше скорость. Со временем скорость реакции обычно снижается, по большей части в результате снижения концентрации субстрата (см. след. разд.).
Концентрация фермента
При высокой концентрации субстрата и при постоянстве других факторов, таких, например, как температура и рН, скорость ферментативной реакции пропорциональна концентрации фермента Катализ осуществляется всегда в условиях, когда концентрация фермента гораздо ниже концентрации субстрата. Поэтому с возрастанием концентрации фермента растет и скорость ферментативной реакции.
Температура
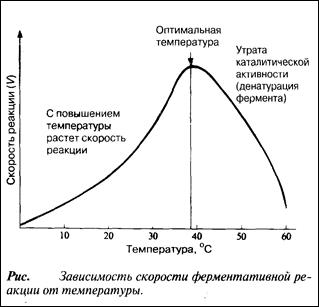 С повышением температуры ускоряется движение молекул, вследствие чего у молекул субстрата и фермента оказывается больше шансов столкнуться друг с другом. В результате увеличивается и вероятность того, что реакция произойдет. Температура, обеспечивающая максимальную активность, называется оптимальной температурой. Если температура поднимается выше этого уровня, скорость ферментативной реакции снижается, несмотря на увеличение частоты столкновений. Происходит это вследствие разрушения вторичной и третичной структур фермента, иными словами, вследствие того, что фермент претерпевает денатурацию (рис.). Молекула фермента развертывается и его активный центр постепенно утрачивает присущую ему форму. Наиболее чувствительны к воздействию высокой температуры водородные связи и гидрофобные взаимодействия.
С повышением температуры ускоряется движение молекул, вследствие чего у молекул субстрата и фермента оказывается больше шансов столкнуться друг с другом. В результате увеличивается и вероятность того, что реакция произойдет. Температура, обеспечивающая максимальную активность, называется оптимальной температурой. Если температура поднимается выше этого уровня, скорость ферментативной реакции снижается, несмотря на увеличение частоты столкновений. Происходит это вследствие разрушения вторичной и третичной структур фермента, иными словами, вследствие того, что фермент претерпевает денатурацию (рис.). Молекула фермента развертывается и его активный центр постепенно утрачивает присущую ему форму. Наиболее чувствительны к воздействию высокой температуры водородные связи и гидрофобные взаимодействия.
Температурный оптимум для большинства ферментов млекопитающих лежит в пределах 37—40 °С. Существуют, однако, ферменты с более высоким температурным оптимумом; у бактерий, живущих в горячих источниках, он может, например, превышать 70оС. Именно такие ферменты используются в качестве добавок к стиральным порошкам для стирки в горячей воде. Когда температура приближается к точке замерзания или оказывается ниже ее, ферменты инактивируются, но денатурации при этом не происходит. С повышением температуры их каталитическая активность вновь восстанавливается.
 рН
рН
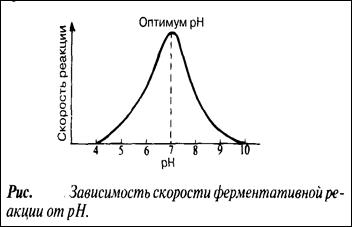
При постоянной температуре любой фермент, как правило, работает наиболее эффективно в узких пределах рН. Оптимальным считается то значение рН, при котором реакция протекает с максимальной скоростью. При более высоких и более низких рН активность фермента снижается. Сдвиг рН меняет заряд ионизированных кислотных и основных групп, что ведет к разрушению ионных связей, участвующих в поддержании специфичной формы молекул фермента. В результате изменяется форма молекул фермента - и в первую очередь форма его активного центра. При слишком резких сдвигах рН фермент денатурирует.
 2015-06-26
2015-06-26 4260
4260
