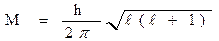| Радиус атома, R (нм)
| • обычно в качестве радиуса атома принимают расстояние от ядра до главного максимума плотности внешних электронных орбиталей;
• увеличение заряда ядра в периодах приводит к уменьшению атомного радиуса, а в главных и третьей побочной подгруппах – к увеличению.
|
| Энергия ионизации Eи (эВ/атом, кДж/моль)
| • энергия, необходимая для удаления электрона из атома, иона, радикала или молекулы в газовой фазе при Т = 0 К без передачи освобожденному атому кинетической энергии
Чем легче атом отдает электрон, тем сильнее его восстановительные свойства. Восстановительная способность атомов с ростом заряда ядра в периодах уменьшается, в главных подгруппах, как правило, растет.
• зависит от электронной конфигурации атома (иона)
• полностью или наполовину заполненные подуровни обладают, как правило, повышенной устойчивостью
|
| Энергия сродства
к электрону,
Eср (кДж/моль,
эВ/атом,)
| • энергия, выделяющаяся при присоединении электрона к нейтральному атому; чем больше Eср, тем сильнее выражены окислительные свойства элемента.
Eср=0 у атомов с устойчивыми электронными конфигурациями s2, s2p6, d10 например: Mg, Ne, Сd (исключения: Be, Zn)
|
| Электро-отрицатель-ность ЭО
| • условная величина, характеризующая способность атома в химическом соединении смещать к себе общую электронную пару;
• зависит от соотношения значений энергии ионизации (Eи) и сродства к электрону (Eср)
|
| Квантовые числа
| • параметры, характеризующие состояние электрона в атоме
|
| Главное квантовое число n
| • определяет основной запас энергии электрона, иными словами, степень его удаленности от ядра, или размер электронного облака (орбитали).
•может принимать целочисленные значения от 1 до ∞
|
| Орбитальное (побочное, азимутальное) квантовое число l
| • определяет орбитальный момент количества движения электрона
• характеризует форму электронного облака
• может принимать все целочисленные значения от 0 до (n – 1)
|
| Магнитное квантовое число ml
| • определяет значение проекции орбитального момента количества движения электрона M на произвольно выделенную ось (например z):
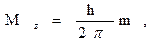 • характеризует пространственную ориентацию электронного облака.
• может принимать все целочисленные значения от – l до + l
• характеризует пространственную ориентацию электронного облака.
• может принимать все целочисленные значения от – l до + l
|
| Спиновое квантовое число s
| • характеризует механический момент электрона, связанный с его собственным движением
• может принимать значения +½ или – ½
|
| Формулы электронного строения атомов
(электронные формулы)
| • показывают распределение электронов в атоме по энергетическим уровням и подуровням
+8O 1s2 2s22p4
|
| Порядок
заполнения энергетических уровней электронами
| • регулируется принципом наименьшей энергии, принципом запрета (Паули);
|
| Принцип наименьшей энергии
| • электроны в первую очередь располагаются в пределах электронного подуровня с наинизшей в данных условиях энергией
|
| Принцип запрета Паули (1925г.)
| • в атоме не может быть двух электронов в одинаковых квантовых состояниях, т.е. с одинаковыми значениями всех четырех квантовых чисел
|
| Правило Гунда (Хунда)
| • суммарное значение спина электронов в подуровне должно быть максимальным
|
| Правила Клечковского
| • Атомные орбитали заполняются в порядке:
1) Увеличения суммы значений главного и орбитального квантовых чисел n + l
2) При одинаковых значениях этой суммы – в порядке возрастания значений главного квантового числа – (n)
|
| Электронные аналоги
| • атомы, у которых валентные электроны расположены на орбиталях, описываемых одинаковой структурой внешних электронных слоев
|
| Изобары
| • атомы, имеющие одинаковые значения массового числа, но различные заряды ядер (атомные номера)
21 21
Ne и Na
10 11
|
| Изотопы
| • разновидности атомов химического элемента, имеющих одинаковое число протонов, но различное число нейтронов в ядрах
21 20
Ne и Ne (11 и 10 нейтронов
10 10 соответственно)
|
| Изотоны
| • атомы, ядра которых содержат одинаковое число нейтронов
20 21
Ne и Na (по 10 нейтронов)
10 11
|
| Квантовая химия
| • учение о строении и физико-химических свойствах молекул (ионов, радикалов, комплексов); включает учение о природе химической связи, валентности, электронной структуре молекул, электрических и магнитных свойствах молекул.
|
| Основные положения квантовой химии (механики)
| • дискретность (квантование) энергии
• корпускулярно – волновой дуализм (двойственная природа микрочастиц – электрона, фотона и т.д.)
• вероятностный характер законов микромира
|
| Волновая функция ψ «пси»
| • математическая функция, описывающая состояние электрона в атоме или молекуле
|
| Принцип неопределенности Гейзенберга
| •микрочастица (так же как и волна) не имеет одновременно точных значений координат и импульса (скорости)
|
| Уравнение Шрёдингера
| • основное уравнение квантовой механики, описывающее поведение квантовомеханической системы во времени и пространстве; его решение дает полную энергию системы и волновую функцию, с помощью которой можно в принципе рассчитать любое наблюдаемое свойство системы
•
¶2Y ¶2Ψ ¶2Y 2m
—— + —— + —— + ——— (Е – Еп)Ψ = 0
¶x2 ¶y2 ¶z2 h2
где Е, Еп – соответственно, полная и потенциальная энергия электрона; m – масса электрона; h – постоянная Планка; Y – волновая функция, квадрат модуля которой ïYï2 характеризует плотность вероятности нахождения электрона в соответствующей области пространства
• решением уравнения Шредингера является математическое описание атомной орбитали, которое возможно лишь при вполне определенных, дискретных значениях квантовых чисел
|
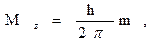 • характеризует пространственную ориентацию электронного облака.
• может принимать все целочисленные значения от – l до + l
• характеризует пространственную ориентацию электронного облака.
• может принимать все целочисленные значения от – l до + l
 2015-06-26
2015-06-26 1748
1748