Коррозия металлов
| Коррозия
| Ÿ самопроизвольное разрушение материала в результате химического или электрохимического взаимодействия с внешней средой
|
| Химическая
коррозия
| Ÿ окисление металлов под действием агрессивных газов при высоких температурах, исключающих конденсацию влаги на поверхности металла, в среде, не проводящей электрический ток:
t0
3Fe + 4H2O(пар) = Fe3O4 + 4H2↑
t0
2Fe + 3Cl2 = 2FeCl3
для процесса окисления металла в атмосферных условиях Δ G < 0, поэтому возможно самопроизвольное протекание процесса коррозии:
Me - ne = Men+.
|
| Электрохимическая коррозия
| Ÿ самопроизвольное разрушение металлов в присутствии электролитов в результате образования гальванического элемента; в отличие от химической коррозии протекает в средах, проводящих электрический ток;
в условиях электрохимической коррозии возникают гальванические микроэлементы;
на аноде такого гальванического элемента происходит окисление металла с образованием катионов металла или нерастворимых продуктов:
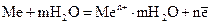 ;
на катоде – происходит восстановление окислителя за счет освободившихся и переместившихся от анода к катоду электронов; как происходит процесс восстановления, определяется средой электролита: ;
на катоде – происходит восстановление окислителя за счет освободившихся и переместившихся от анода к катоду электронов; как происходит процесс восстановления, определяется средой электролита: 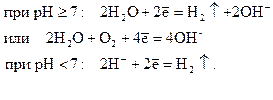 Ÿ возникновение и работа гальванического элемента (коррозионной пары) становится возможным в следующих случаях:
- соприкосновение металла с водой (жидкостная коррозия)
- соприкосновения с влажным воздухом и влажным газом (атмосферная коррозия) и т. д.
- соприкосновения двух различных по активности металлов, при этом образуется гальваническая пара, процесс протекает самопроизвольно в направлении растворения наиболее активного металла.
- неодинаковой аэрации (доступа воздуха) к различным участкам металлической поверхности
- наличия в металле токопроводящих неметаллических примесей
- неодинаковой механической обработке (прокат, волочение, сверление, и пр.) металлов.
Ÿ возникновение и работа гальванического элемента (коррозионной пары) становится возможным в следующих случаях:
- соприкосновение металла с водой (жидкостная коррозия)
- соприкосновения с влажным воздухом и влажным газом (атмосферная коррозия) и т. д.
- соприкосновения двух различных по активности металлов, при этом образуется гальваническая пара, процесс протекает самопроизвольно в направлении растворения наиболее активного металла.
- неодинаковой аэрации (доступа воздуха) к различным участкам металлической поверхности
- наличия в металле токопроводящих неметаллических примесей
- неодинаковой механической обработке (прокат, волочение, сверление, и пр.) металлов.
|
| Четыре группы металлов по отношению к электрохимической коррозии
| а) металлы повышенной активности (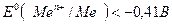 ) – корродируют даже в нейтральных водных средах (в ряду напряжений занимают место от щелочных металлов до кадмия)
б) металлы средней активности – устойчивы в нейтральных растворах при отсутствии кислорода и не устойчивы в кислых средах (в ряду напряжений расположены от кадмия до водорода)
в) металлы малой активности ( ) – корродируют даже в нейтральных водных средах (в ряду напряжений занимают место от щелочных металлов до кадмия)
б) металлы средней активности – устойчивы в нейтральных растворах при отсутствии кислорода и не устойчивы в кислых средах (в ряду напряжений расположены от кадмия до водорода)
в) металлы малой активности (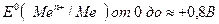 ) – в отсутствие кислорода и других окислителей устойчивы не только в нейтральных, но и в кислых средах (к таким металлам относятся: висмут, медь, мышьяк, серебро, ртуть, родий и др.)
г) благородные металлы – устойчивы во всех средах, кроме кислых в присутствии сильных окислителей (золото, платина, иридий, палладий) ) – в отсутствие кислорода и других окислителей устойчивы не только в нейтральных, но и в кислых средах (к таким металлам относятся: висмут, медь, мышьяк, серебро, ртуть, родий и др.)
г) благородные металлы – устойчивы во всех средах, кроме кислых в присутствии сильных окислителей (золото, платина, иридий, палладий)
|
| Примеры процессов электрохимической коррозии
| а) в растворе соляной кислоты
при контакте железа с медью в кислой среде возникает гальванический элемент 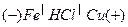 .
Более активный металл – железо – окисляется: (Fе – 2ē = Fe2+ −анодный процесс), посылая электроны атомам меди, и переходит в раствор в виде ионов Fe2+. Ионы водорода восстанавливаются на меди: (2Н++2ē = Н20− катодный процесс);
б) анодный процесс в нейтральной среде протекает аналогично процессу в кислой: Fe0-2ē = Fe2+;
Катодный процесс – восстановление кислорода, растворенного в электролите:
О2 + 4ē + 2Н2О = 4ОН¯.
ионы ОН- взаимодействуют с перешедшими в раствор ионами Fе2+:
Fe2++2OH¯ = Fe(OH)2;
4Fe(OH)2 + 2H2O + O2 = 4 Fe(OH)3.
Гидроксид Fe(OH)3 может отщеплять воду:
Fe(OH)3 = Fe(O)OH + H2O. .
Более активный металл – железо – окисляется: (Fе – 2ē = Fe2+ −анодный процесс), посылая электроны атомам меди, и переходит в раствор в виде ионов Fe2+. Ионы водорода восстанавливаются на меди: (2Н++2ē = Н20− катодный процесс);
б) анодный процесс в нейтральной среде протекает аналогично процессу в кислой: Fe0-2ē = Fe2+;
Катодный процесс – восстановление кислорода, растворенного в электролите:
О2 + 4ē + 2Н2О = 4ОН¯.
ионы ОН- взаимодействуют с перешедшими в раствор ионами Fе2+:
Fe2++2OH¯ = Fe(OH)2;
4Fe(OH)2 + 2H2O + O2 = 4 Fe(OH)3.
Гидроксид Fe(OH)3 может отщеплять воду:
Fe(OH)3 = Fe(O)OH + H2O.
|
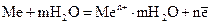 ;
на катоде – происходит восстановление окислителя за счет освободившихся и переместившихся от анода к катоду электронов; как происходит процесс восстановления, определяется средой электролита:
;
на катоде – происходит восстановление окислителя за счет освободившихся и переместившихся от анода к катоду электронов; как происходит процесс восстановления, определяется средой электролита: 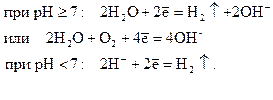 Ÿ возникновение и работа гальванического элемента (коррозионной пары) становится возможным в следующих случаях:
- соприкосновение металла с водой (жидкостная коррозия)
- соприкосновения с влажным воздухом и влажным газом (атмосферная коррозия) и т. д.
- соприкосновения двух различных по активности металлов, при этом образуется гальваническая пара, процесс протекает самопроизвольно в направлении растворения наиболее активного металла.
- неодинаковой аэрации (доступа воздуха) к различным участкам металлической поверхности
- наличия в металле токопроводящих неметаллических примесей
- неодинаковой механической обработке (прокат, волочение, сверление, и пр.) металлов.
Ÿ возникновение и работа гальванического элемента (коррозионной пары) становится возможным в следующих случаях:
- соприкосновение металла с водой (жидкостная коррозия)
- соприкосновения с влажным воздухом и влажным газом (атмосферная коррозия) и т. д.
- соприкосновения двух различных по активности металлов, при этом образуется гальваническая пара, процесс протекает самопроизвольно в направлении растворения наиболее активного металла.
- неодинаковой аэрации (доступа воздуха) к различным участкам металлической поверхности
- наличия в металле токопроводящих неметаллических примесей
- неодинаковой механической обработке (прокат, волочение, сверление, и пр.) металлов.
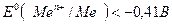 ) – корродируют даже в нейтральных водных средах (в ряду напряжений занимают место от щелочных металлов до кадмия)
б) металлы средней активности – устойчивы в нейтральных растворах при отсутствии кислорода и не устойчивы в кислых средах (в ряду напряжений расположены от кадмия до водорода)
в) металлы малой активности (
) – корродируют даже в нейтральных водных средах (в ряду напряжений занимают место от щелочных металлов до кадмия)
б) металлы средней активности – устойчивы в нейтральных растворах при отсутствии кислорода и не устойчивы в кислых средах (в ряду напряжений расположены от кадмия до водорода)
в) металлы малой активности (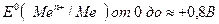 ) – в отсутствие кислорода и других окислителей устойчивы не только в нейтральных, но и в кислых средах (к таким металлам относятся: висмут, медь, мышьяк, серебро, ртуть, родий и др.)
г) благородные металлы – устойчивы во всех средах, кроме кислых в присутствии сильных окислителей (золото, платина, иридий, палладий)
) – в отсутствие кислорода и других окислителей устойчивы не только в нейтральных, но и в кислых средах (к таким металлам относятся: висмут, медь, мышьяк, серебро, ртуть, родий и др.)
г) благородные металлы – устойчивы во всех средах, кроме кислых в присутствии сильных окислителей (золото, платина, иридий, палладий)
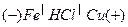 .
Более активный металл – железо – окисляется: (Fе – 2ē = Fe2+ −анодный процесс), посылая электроны атомам меди, и переходит в раствор в виде ионов Fe2+. Ионы водорода восстанавливаются на меди: (2Н++2ē = Н20− катодный процесс);
б) анодный процесс в нейтральной среде протекает аналогично процессу в кислой: Fe0-2ē = Fe2+;
Катодный процесс – восстановление кислорода, растворенного в электролите:
О2 + 4ē + 2Н2О = 4ОН¯.
ионы ОН- взаимодействуют с перешедшими в раствор ионами Fе2+:
Fe2++2OH¯ = Fe(OH)2;
4Fe(OH)2 + 2H2O + O2 = 4 Fe(OH)3.
Гидроксид Fe(OH)3 может отщеплять воду:
Fe(OH)3 = Fe(O)OH + H2O.
.
Более активный металл – железо – окисляется: (Fе – 2ē = Fe2+ −анодный процесс), посылая электроны атомам меди, и переходит в раствор в виде ионов Fe2+. Ионы водорода восстанавливаются на меди: (2Н++2ē = Н20− катодный процесс);
б) анодный процесс в нейтральной среде протекает аналогично процессу в кислой: Fe0-2ē = Fe2+;
Катодный процесс – восстановление кислорода, растворенного в электролите:
О2 + 4ē + 2Н2О = 4ОН¯.
ионы ОН- взаимодействуют с перешедшими в раствор ионами Fе2+:
Fe2++2OH¯ = Fe(OH)2;
4Fe(OH)2 + 2H2O + O2 = 4 Fe(OH)3.
Гидроксид Fe(OH)3 может отщеплять воду:
Fe(OH)3 = Fe(O)OH + H2O.
 2015-06-26
2015-06-26 461
461








