В математической форме зависимость скорости от концентрации представляется в виде кинетического уравнения. Скорость ферментативной реакции зависит как от концентрации субстрата, так и от концентрации фермента при прочих равных условиях (Т, рН). Необходимо учитывать, что фермент высокомолекулярное вещество, и его концентрация во много раз меньше, чем концентрация субстрата. Пусть в растворе содержатся субстрат с M r = 100 и фермент c M r = 100000. Массовые концентрации обоих реактантов 1 мг/л. Их молярные концентрации будут:
с(S) = 1×10–5 моль/л, с(E) = 1×10–8 моль/л
На 1000 молекул субстрата приходится одна молекула фермента. Реальное соотношение может быть значительно больше. Этим определяется форма кинетических уравнений в ферментативной кинетике.
Далее рассмотрим реакцию, в которой участвуют фермент и только один субстрат. Но выводы будут справедливы и для более сложных реакций, в которых участвуют субстрат и реагент, или два субстрата.
Типичной особенностью кинетики ферментативных реакций оказалось, что скорость пропорциональна концентрации субстрата при его малой концентрации, и становится независимой от концентрации при большой концентрации. Эти результаты эксперимента графически изображаются кривой линией на рис. 3.
|
|
|
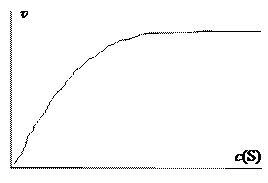
Рис. 3
Для объяснения этой зависимости была предложена схема реакции в две стадии. В начале по обратимой реакции образуется фермент-субстратный комплекс S … E, в котором происходит преобразование молекулы субстрата. На второй стадии связь изменившейся молекулы субстрата с ферментом разрывается, и появляется свободная молекула продукта P. Каждый этап превращения характеризуется своей константой скорости.
k 1 k 2
 S + E S .... E ® E + P
S + E S .... E ® E + P
k –1
Для процесса с таким механизмом Л. Михаэлисом и Ментен было выведено уравнение зависимости скорости от концентрации S, получившее название уравнения Михаэлиса-Ментен.
(Далее вывод уравнения при чтении лекции может быть пропущен.)
Напишем кинетические уравнения для образования конечного продукта и фермент-субстратного комплекса:
v = 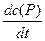 = k2c (S×××E) (1)
= k2c (S×××E) (1)
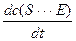 = k1c (S) c (E) - k-1c (S×××E) - k2c (S×××E) (2)
= k1c (S) c (E) - k-1c (S×××E) - k2c (S×××E) (2)
Общая (начальная) концентрация фермента всегда много меньше концентрации субстрата, что отмечено выше. В ходе реакции концентрация свободного фермента c (E) уменьшается вследствие образования комплекса
c (E) = co (E) - c (S×××E) (3)
В стационарном состоянии концентрация комплекса остается постоянной:
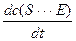 = 0
= 0
Из этого условия получаем
k1c (S) c (E) - k-1c (S×××E) - k2c (S×××E) = 0 (4)
Подставляем выражение (3) в (4)
k1 c(S)[ co (E) - c (S×××E)] - k-1c (S×××E) - k2c (S×××E) = 0 (5)
|
|
|
В уравнении (5) раскрываем квадратные скобки и преобразуем его для нахождения концентрации фермент-субстратного комплекса S×××E:
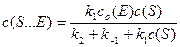
Делением числителя и знаменателя на k 1, получаем
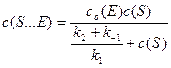 (6)
(6)
Выражение, состоящее из констант, в знаменателе уравнения называют константой МихаэлисаKM:
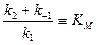 (7)
(7)
Подставляем полученное выраженеие в ур. 1:
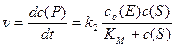 (8)
(8)
Полученное ур. 8 – одна из форм записи уравнения Михаэлиса-Ментен. Проанализируем это уравнение. Во многих ферментативных реакциях константа второй стадии k 2 значительно меньше констант образования k 1 и распада k –1 фермент-субстратного комплекса. В таких случаях константа Михаэлиса приблизительно равна константе равновесия распада комплекса на исходные молекулы:
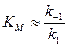
При большой концентрации субстрата, когда c (S)>> KМ, константой KМ можно пренебречь, и тогда c (S) в ур. 8 сокращается; при этом скорость принимает максимальное значение:
v макс = k 2 c o(E) (9)
Максимальная скорость зависит от концентрации фермента и не зависит от концентрации субстрата. Это означает, что реакция идет по нулевому порядку относительно субстрата.
При малой концентрации субстрата, когда c (S)<< KМ, реакция идет по первому порядку относительно субстрата:
v = 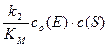
Таким образом, при увеличении концентрации субстрата порядок реакции изменяется от первого (область I на рис. 4) до нулевого (область III).
|

рис. 4
Уравнение Михаэлиса-Ментен можно записать с использованием максималоной скорости:
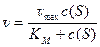 (10)
(10)
Эта форма уравнения удобна для представления результатов эксперимента, когда не известна концентрация фермента.
Если скорость реакции равна половине максимальной скорости, то из ур. 10 следует, что константа Михаэлиса равна соответствующей концентрации субстрата (рис. 4):
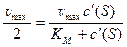 , откуда K M = c '(S)
, откуда K M = c '(S)
Для более точного определения константы Михаэлиса графическим методом было предложено преобразование ур. 10 через обратные значения переменных. Меняем местами числитель и знаменатель в ур. 10:
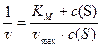 или
или 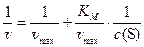 (11)
(11)
Графическое представление уравнения Михаэлиса-Ментен в обратных координатах 1/ v – 1/ c (S) называют графиком Лайнуивера-Бёрка (рис. 5). Это график прямой линии, которая отсекает на оси 1/ v отрезок, равный обратному значению максимальной скорости. Продолжение прямой линии в отрицательную область до пересечения с горизонтальной осью дает отрезок, абсолютное значение которого равно 1/ K M. Таким образом, из графика определяются обратные значения параметров 1/ v max и 1/ K M, а затем и сами параметры.
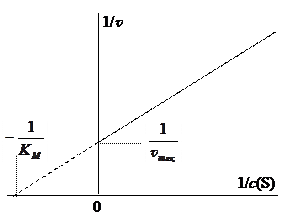
рис. 5
Есть ферменты, действие которых не строго подчиняется ур. Михаэлиса-Ментен. При высокой концентрации субстрата максимальная скорость достигается, но при низкой концентрации график зависимости v – S принимает так называемый сигмоидный вид. Это означает, что сначала скорость увеличивается с ускорением (выгнутость кривой направлена вниз, см. рис. 6), а затем после точки перегиба скорость увеличивается с замедлением и приближается к максимальной скорости. Это объясняется кооперативным влиянием субстрата при наличии в ферменте нескольких центров связывания. Связывание одной молекулы S способствует связыванию второй молекулы на другом центре.

Рис. 6
 2015-06-26
2015-06-26 644
644








