Ідеальний газ – модель для вивчення процесів в реальних газах. Але процеси в реальних газах описуються рівняннями та газовими законами лише при незначних тисках та високих температурах. З підвищенням тиску та зменшенням температури спостерігаються значні відхилення дослідних даних від теоретичних розрахунків.
Розглянемо один моль газу. Для нього справедливе твердження
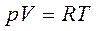
Але досліди, проведені з 1л азоту при різних тисках дають такі результати:
| № досліду | |||||
| Тиск р, атм | |||||
| pV, атм.л | 1,000 | 0,994 | 1,048 | 1,390 | 2,069 |
Причиною неспівпадіння є те, що з підвищенням тиску все більше проявляється власний об’єм молекул, а зближення молекул приводять до збільшення кількості їх зіткнень, отже, до збільшення тиску. Власний об’єм та міжмолекулярна взаємодія є причиною розходження теорії та практики.
Для опису поведінки реальних газів було запропоновано багато рівнянь. Найпростішим з них та таким, що дає досить добрі результати, є рівняння Ван-дер-Ваальса, отримане шляхом внесення поправок в рівняння Клапейрона для одного моля газу:
|
|
|
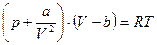
р - зовнішній тиск (дорівнює тиску газу на стінки посудини;
a,b – константи Ван-дер-Ваальса, різні для різних газів, визначені дослідним шляхом.
Поправка 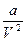 характеризує добавку до зовнішнього тиску, що зумовлена взаємним протягуванням молекул. Помітний вплив молекул одна на одну здійснюється в межах невеликих відстаней (
характеризує добавку до зовнішнього тиску, що зумовлена взаємним протягуванням молекул. Помітний вплив молекул одна на одну здійснюється в межах невеликих відстаней (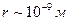 ). Така відстань називається радіусом молекулярної дії.
). Така відстань називається радіусом молекулярної дії.
Внаслідок того, що молекули маюьб скінченний об'єм, простір, в якому можуть рухатися молекули, менше об'єму посудини. Поправка b характеризує ту частину об'єму, яка недоступна для руху молекул.
Для довільної маси газу рівняння прийме вигляд
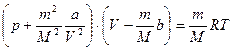
Для реальних газів лише наближено виконується рівняння Ван-дер-Ваальса. Уявний газ, який точно описується рівнянням Ван-дер-Ваальса, називають ван-дер-ваальсовським. Внутрішня енергія такого газу, крім кінетичної енергії молекул, повинна включати вотенціальну енергію їх взаємодії.
Робота протии сил взаємодії 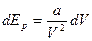 , отже,
, отже,
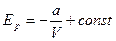
Тоді внутрішня енергія одного моля газу дорівнює
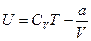
а для довільної маси газу: 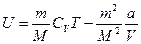
 2015-06-26
2015-06-26 529
529








