Саратовский государственный технический университет
ОПРЕДЕЛЕНИЕ ХИМИЧЕСКОГО ЭКВИВАЛЕНТА, ЭКВИВАЛЕНТНОЙ И АТОМНОЙ МАССЫ МЕТАЛЛА
Методические указания
к выполнению лабораторной работы
по химии
для студентов всех специальностей
Одобрено
редакционно-издательским советом
Саратовского государственного
технического университета
Саратов 2011
Цель работы:
1. Ознакомить студентов с основными химическими законами и единицами массы.
2. С помощью математической обработки подученных студентами экспериментальных данных сделать вывод о названии металла, данного для работы и его положении в периодической таблице Д.И. Менделеева.
ОСНОВНЫЕ ПОНЯТИЯ
Вспомним основные частицы вещества:
Молекула – наименьшая частица вещества, обладающая его химическими свойствами и состоящая из атомов. Атом – наименьшая частица элемента, обладающая его химическими свойствами. Химический элемент можно определить как вид атомов, характеризующийся определенной совокупностью свойств.
|
|
|
Простейшим примером сказанному может служить молекула хлористого водорода (HCl). Водород и хлор, вступая в реакцию, теряют свои свойства, характерные для газообразных Н2 и Cl2, поэтому считается, что в состав хлористого водорода входят элементы – водород и хлор.
Масса атомов и молекул выражается в атомных единицах массы (а.е.м.), принятых в 1961 г. За одну атомную единицу массы принимается 1/12 часть массы атома изотопа углерода 12С. Таким образом, масса атома или молекулы любого вещества представляется относительной величиной, показывающей, во сколько раз масса данного атома (молекулы) тяжелее выбранной атомной единицы массы.
Так, относительная атомная масса цинка (Ar) равна 65.38 а.е.м., относительная молекулярная масса воды (Mr) равна 1,008 ∙ 2 + 15,9994 = 18,0154 а.е.м. и т.д.
Однако при решении задач и в расчетах по уравнениям реакций гораздо чаще пользуются понятием «моль».
Моль – это количество вещества, содержащее столько молекул, атомов, ионов, электронов или других структурных единиц, сколько содержится атомов в 12 граммах изотопа углерода 12C.
Применяя слово «моль», необходимо в каждом случае точно указывать, какие единицы входят в данное вещество. Существует понятия «моль атомов», «моль молекул» и т.д. Масса одного моля взятого вещества называется его молярной массой. Она выражается в г/моль.
Числовое значение молярной массы вещества в г/моль равно относительной молекулярной массе Mr, если вещество состоит из молекул, или относительной атомной массе Ar, если вещество состоит из атомов. Например, молярная масса атомарного кислорода равна ~16 г/моль, молекулярного кислорода ~32 г/моль.
|
|
|
Моль любого вещества содержит совершенно одинаковое количество структурных единиц. Это число называет числом Авогадро, его значение принимают равным 6,02·1023.
Часто в химических расчетах используется понятие эквивалента.
Эквивалентом вещества называется такое его количество, которое соединяется без остатка с 1 молем атомов водорода или замещает то же количество атомов водорода в химических реакциях.
Например, в соединениях HCl, H2S и NH3 эквивалент элементов хлора, серы и азота соответственно равен 1 моль, ½ моля и 1/3 моля. Масса одного эквивалента называется его эквивалентной массой или молярной массой эквивалента. Выражается в г/моль.
Так, в приведенных примерах эквивалентные массы хлора, серы и азота легко подсчитать, используя атомные массы этих элементов, они соответственно равны m э(Cl) = 35,5 г/моль; m э(S) = 32:2 = 16 г/моль; m э(N) = 14:3 = 4,7 г/моль. Из разобранных примеров видно, что эквивалентная масса элемента находится из соотношения
Эквивалентная масса 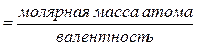 или
или 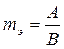 .
.
Понятие об эквивалентах и эквивалентных массах распространяется также на сложные вещества. Эквивалентом сложного вещества называется такое его количество, которое взаимодействует без остатка с одним эквивалентом водорода или вообще с одним эквивалентом любого другого вещества.
1. Эквивалентная масса оксида складывается из значений эквивалентных масс, составляющих оксид элементов.
а) Эквивалентные массы металла и кислорода в оксиде ZnO, соответственно, равны половине молярных масс атомов:
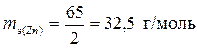 ,
, 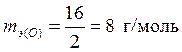 ,
,
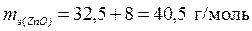 .
.
б) Валентность серы в оксиде SO3 равна 6, следовательно
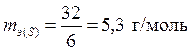 ,
, 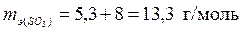 .
.
2. Эквивалентная масса кислоты равна её молярной массе, деленной на основность кислоты (число атомов водорода в молекуле кислоты).
а) Молярная масса HNO3 равна 63 г/моль. Кислота одноосновная, следовательно 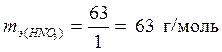 .
.
б) Молярная масса H3PO4 равна 98 г/моль. Основность равна 3.
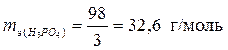 .
.
3. Эквивалентная масса основания равна его молярной массе, деленной на валентность металла, образующего основание.
Молярная масса Mg(OH)2 равна 58 г/моль, валентность цинка 2. 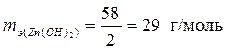 .
.
4. Эквивалентная масса соли равна отношению её молярной массы к произведению валентности металла на число его атомов в молекуле.
а) Молярная масса Na2CO3 равна 106 г/моль. Валентность металла I, число его атомов 2.
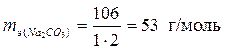 .
.
б) Al2(SO4)3 Молярная масса 342 г/моль.
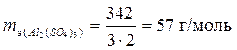 .
.
5. Эквиваленты одних и тех же сложных веществ и их эквивалентные массы могут иметь различные значения, если их рассматривать не как отдельные вещества, а составные части химических реакций, в которых они участвуют.
Так, в примерах
| H2CO3 + 2NaOH = Na2CO3 + 2H2O | (1) |
| H2CO3 + NaOH = NaHСO3 + H2O | (2) |
эквивалент H2CO3 и его масса зависит от количества атомов водорода, участвующих в реакции и соответственно равны:
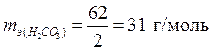 , , 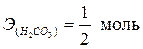 – по уравнению (1); – по уравнению (1);
| (1) |
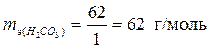 , , 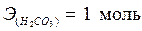 – по уравнению (2); – по уравнению (2);
| (2) |
| Cr(OH)3 + 2HCl = CrOHCl2 + 2H2O; | (3) |
| Cr(OH)3 + 3HCl = CrCl3 + 3H2O; | (4) |
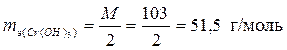 , , 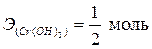 – по уравнению (3); – по уравнению (3);
| (3) |
т.к. в реакции было замещено только две гидроксидных группы на кислотный остаток.
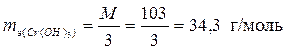 , , 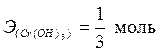 – по уравнению (4); – по уравнению (4);
| (4) |
т.к. произошло замещение всех трех гидроксогрупп.
Известно несколько способов определения эквивалента.
I. Прямое или непосредственное определение эквивалента из соединения элементов с водородом или кислородом.
Пример 1. Рассчитать эквивалент железа в его оксиде FeO.
Эквивалент кислорода по определению равен ½ моля атомов, эквивалентная масса кислорода равна 16: 2 = 8 г/моль. В данном соединении на ½ моля атомов кислорода приходится столько же, т.е. ½ моля атомов железа. Следовательно, эквивалент железа в данном оксиде равен ½ моля, а его эквивалентная масса 56: 2 = 28 г/моль.
II. Определение эквивалента с помощью закона эквивалентов.
Закон эквивалентов (эквивалентных масс), предложенный в 1803-1814 гг. Дальтоном и Рихтером: Элементы и вещества соединяются друг с другом, а также замещают друг друга, в химических реакциях в строго определенных весовых количествах, прямо пропорциональных их эквивалентам.
|
|
|
Математическая запись закона такова:
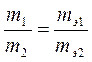 , ,
| (I) |
где m1 и m2 – массы взаимодействующих элементов или веществ, г;
mЭ1 и mЭ2 – соответственно эквивалентные массы этих веществ, г/моль.
Пример 2. Определить эквивалентную и молярную массы 3-валентного металла, зная, что 0,52 г его при окислении образуют 0,98 г оксида.
Решение. В соответствии с законом эквивалентов
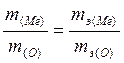 .
.
Массу кислорода определим по разности масс оксида и металла
mO = 0,98 – 0,52 = 0,46 г.
Эквивалентная масса кислорода известна, она равна 8 г/моль.
Тогда
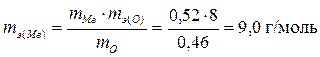 .
.
Т.к. валентность металла равна 3, то его молярная масса
A = mэ(Me)·В = 9,0·3 = 27 г/моль.
Пример 3. Вычислить эквивалентную массу металла, если в его хлориде массовая доля хлора 79,78 %, эквивалентная масса хлора равна 53,45 г/моль.
Решение. Массовая доля w металла в хлориде равна
w = 100 - 79,78 = 20,22 %.
Согласно закону эквивалентов, отношение массы металла и массы хлора в соединении должно быть равно отношению их эквивалентных масс
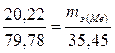 ,
,
отсюда 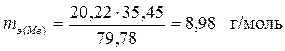 .
.
Пример 4. Определите молярную массу двух валентного металла, если 14,2 г оксида этого металла образуют 30,2 г сульфата металла.
Решение. Эквивалентная масса оксида металла равна mэ(MeO) = mэ(Me) + mэ(O) = mэ(Me) + 8.
Эквивалентная масса сульфата металла равна 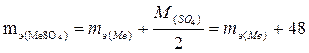 .
.
Согласно закону эквивалентов
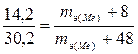 ,
,
mэ(Me) = 27,5 г/моль.
Т.к. валентность металла равна 2, то его молярная масса равна:
A = 27,5 · 2 = 55 г/моль.
III. Если в химической реакции одно из участвующих веществ находится в газообразном состоянии, то запись закона эквивалентов выражается формулой
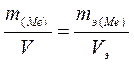 (II) (II)
|
где соответственно m(Me) и mэ(Me) – масса металла и его эквивалентная масса, а V и Vэ - объем вступившего в реакцию газа и объем эквивалентной массы этого газа.
Для расчета объемов реагирующих газов необходимо знание Закона Авогадро и его следствий.
Закон Авогадро (1911): В равных объемах различных газов при постоянных температуре и давлении содержится одинаковое число молекул.
|
|
|
Следствия из закона Авогадро:
1. Один моль любого газа при нормальных условиях (н.у.) –температура 0 ºС и давление 760 мм.рт.ст. занимает один и тот же объем равный 22,4 литра. Этот объем называют – молярным объемом газа VМ = 22,4 л/моль.
2. Один моль любого газа содержит одно и то же число молекул, а именно NA = 6,02 · 1023 моль-1.
3. Относительная плотность одного газа по другому равна отношению их молярных (M) или относительных молекулярных масс
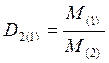 . (III)
. (III)
На основании этих следствий можно рассчитать количество вещества
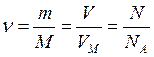 . (IV)
. (IV)
Пример 5. Рассчитать массу 3 л хлора, взятого при н.у.
Решение. Т.к. молярная масса хлора (Cl2) равна 35,5 ∙ 2 = 71 г/моль то из соотношения (IV) легко найти массу искомого объема
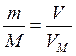 ,
, 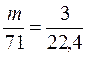 .
.
Таким образом 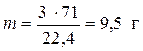 .
.
Пример 6. Сколько молей и сколько молекул содержится в 2,2 г углекислого газа? Какой объем они занимают при н.у.?
Решение. Т.к. молярная масса углекислого газа (СО2) равна 44 г/моль, то
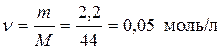 .
.
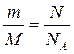 ,
, 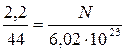 ,
,
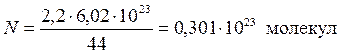 .
.
Найдем объем газа при н.у.
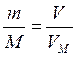 ,
, 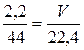 ,
,
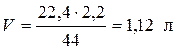 .
.
Пример 7. Определите массу молекулы газа, если масса 2 л газа (н.у.) равна 0,357 г.
Решение. Исходя из молярного объема газа определим молярную массу газа
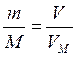 ,
, 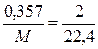 ,
,
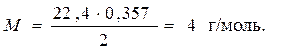
Число молекул в 1 моль любого вещества равно постоянной Авогадро. Следовательно, масса молекул газа (m) равна
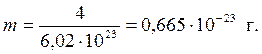
Первое следствие из закона Авогадро позволяет рассчитать объемы эквивалентных масс различных газов:
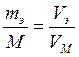 .
.
Так, если эквивалентная масса водорода равна 1,008 г/моль, то её объем равен
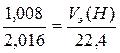 ,
,
V э(H) = 11,2 л/моль.
Подобным образом находится объем эквивалентной массы кислорода, который оказывается равным
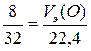 ,
,
V э(O) = 5,6 л/моль.
Пример 8. При растворении 0,506 г металла в серной кислоте выделилось 100,8 мл водорода, измеренного при н.у. Определить эквивалентную массу металла.
Задачу можно решить двумя способами:
а) прямой подстановкой данных в формулу (II).
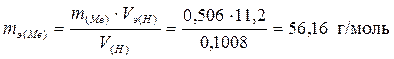 ,
,
б) используя формулу (I), откуда
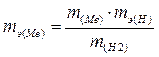 , где mэ(H) = 1,008 г/ моль.
, где mэ(H) = 1,008 г/ моль.
Для решения задачи в этом случае надо найти m (H2). Согласно следствию из закона Авогадро
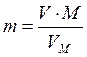 ,
, 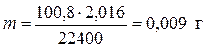 .
.
Теперь найденное значение m (H2) подставим в формулу (I)
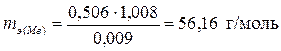 .
.
Значения эквивалентных масс позволяют определить атомную массу металлов по формуле:
A = т э · В, (V)
где В – валентность металла
А – его атомная масса, в г/моль.
Если же валентность металла неизвестна, то атомную массу можно определить через удельную теплоемкость. В данных расчетах используется правило Дюлонга и Пти: Произведение удельной теплоемкости простого твердого вещества на его атомную массу для большинства элементов приблизительно одинаково. Полученная величина имеет среднее значение, равное 26,8 Дж/моль·К (6,3 кал/моль·град). Она носит название атомной теплоемкости металлов (СА) и представляет собой количество тепла, необходимого для нагревания 1 моля атомов металла на один Кельвин. Математически это правило имеет вид
| СА = А · С ~ 26,8 Дж/моль·К | (VI) |
где С – удельная теплоемкость металла, Дж/г·К;
А – атомная масса взятого металла, г/моль.
Под удельной теплоемкостью понимается то количество тепла, которое необходимо затратить для нагревания 1 г вещества на 1 Кельвин.
Пример 9. При окислении 0,16 г металла образовалось 0,223 г оксида. Вычислить точную атомную массу металла, зная, что удельная теплоемкость 0,635 Дж/г·К.
Решение. По правилу Дюлонга и Пти найдем приближенное значение атомной массы данного металла
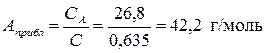 .
.
По формуле (1) найдем эквивалентную массу этого металла. Масса кислорода 0,223 г. – 0,16 г. = 0,063 г.
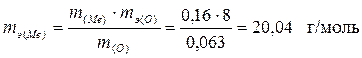 .
.
Зная приближенную атомную массу металла и его эквивалентнуюмассу, можно найти валентность этого металла.
Полученное значение «В» округляем до целого числа.
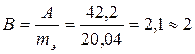 .
.
Точная молярная масса металла находится из соотношения
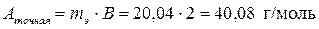 .
.
 2015-07-14
2015-07-14 3577
3577