Перечисление свойств энтропии дано применительно к термодинамике Гиббса; примеры, приводимые для иллюстрации перечисляемых свойств энтропии, относятся, как правило, к открытым однородным термодеформационным системам, для которых справедливо фундаментальное уравнение Гиббса в энтропийном выражении[58][59]:
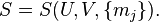
| (Фундаментальное уравнение Гиббса в энтропийном выражении для открытой термодеформационной системы) |
· Энтропия в фундаментальном уравнении в энтропийном выражении есть однозначная дифференцируемая функция аддитивных независимых переменных[60][42][61]с непрерывными первыми и кусочно-непрерывными вторыми производными.
· Энтропия есть величина аддитивная[62][63][64][65], т. е. энтропия термодинамической системы равна сумме энтропий всех её частей. Аддитивность энтропии позволяет распространить это понятие на термодинамические системы любой сложности.
Как следствие аддитивности получаем, что энтропия в фундаментальном уравнении в энтропийном выражении есть однородная функция первого порядка всех независимых переменных[66][61], т. е. для 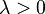
|
|
|
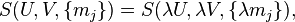
|
и для неё справедливо тождество (теорема) Эйлера[67]:
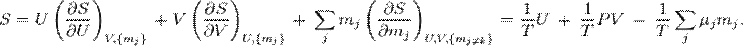
|
· Для однородной системы частная производная энтропии по внутренней энергии есть величина, обратная абсолютной термодинамической температуре (термодинамическая дефиниция температуры как следствие второго начала термодинамики)[68][69][70][71]:
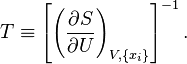
| (Термодинамическая дефиниция температуры) |
В соответствии с теоремой об обратных величинах [72] это определение совпадает с дефиницией равновесной температурой по Гиббсу[73][69][70]:
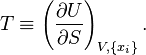
| (Термодинамическая температура по Гиббсу) |
· Энтропия есть монотонная функция внутренней энергии 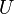 , т. е. абсолютная термодинамическая температура не может менять свой знак[58]. В шкале Кельвинаабсолютная термодинамическая температура всегда положительна[74]. Использование отрицательных по шкале Кельвина температур есть удобный математический приём описания неравновесных подсистем систем с особыми свойствами[75].
, т. е. абсолютная термодинамическая температура не может менять свой знак[58]. В шкале Кельвинаабсолютная термодинамическая температура всегда положительна[74]. Использование отрицательных по шкале Кельвина температур есть удобный математический приём описания неравновесных подсистем систем с особыми свойствами[75].
· Энтропия есть величина полуограниченная. Традиционно принимают, что энтропия ограничена снизу, т. е. для каждой термодинамической системы существует состояние с наименьшей энтропией[76].
· Температура есть величина полуограниченная. Абсолютная температурная шкала Кельвина построена так, что
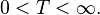
Нуль и бесконечность допустимы в качестве пределов[76].
· Для любой термодинамической системы состояния с наименьшей энтропией и наименьшей температурой совпадают (постулат Планка)[76][77]. С приближением температуры к абсолютному нулю энтропия перестаёт зависеть от температуры и приближается к определённому постоянному значению, которое можно положить равным нулю[78] и принять за начало отсчёта энтропии, устранив тем самым упомянутый в разделе Энтропия простой системы произвол в выборе постоянной интегрирования для энтропии:
|
|
|
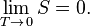
| (Третье начало термодинамики; тепловая теорема Нернста) |
Согласно постулату Тиссы внутренняя энергия ограничена и эта граница соответствует абсолютному нулю температуры[76][79]. Таким образом, состояние системы при абсолютном нуле температуры, когда все термодинамические величины, характеризующие равновесное состояние, перестают зависеть от температуры[80], наилучшим образом подходит в качестве стандартного состояния начала отсчёта основных термодинамических величин.
· Энтропия изолированной системы в состоянии термодинамического равновесия имеет максимальное значение (постулат Гиббса)[81][80], т. е. для равновесия изолированной системы необходимо и достаточно, чтобы при всех возможных (не нарушающих постоянства внутренней энергии, обобщённых координат и масс компонентов) изменениях её состояния вариация энтропии 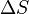 системы не была положительной[82]:
системы не была положительной[82]:
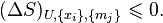
| (Условие равновесия изолированной системы) |
Поскольку речь идёт об изолированной системе, внешнее воздействие на которую запрещено, понятие вариации в данном случае означает виртуальное изменение энтропии[83]. Знак равенства в этом выражении относится к безразличному равновесию.
Условие равновесия Гиббса вытекает из входящего в состав второго начала термодинамики постулата Клаузиуса о неубывании энтропии адиабатно изолированной системы[82]
· Энтропия в фундаментальном уравнении в энтропийном выражении есть характеристическая функция, т. е. фундаментальное уравнение содержит все термодинамические сведения о данной системе
 2015-07-14
2015-07-14 1923
1923








