Если в качестве окислителей используют перманганат калия и бихромат калия, то записать продукты реакции помогут таблицы:
Окислительные свойства калия перманганата.
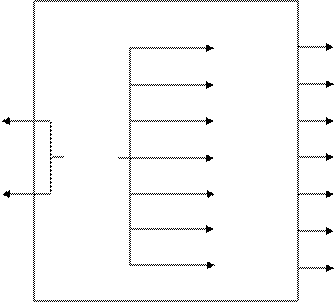 |
HCI
HCI CI2˚
H2SO4
H2S S˚
H2SO4
KCI + MnCI2 + H2O KI I2˚
H2SO4
KMnO4 H2O2 O2˚
H2SO4
K2SO4 + MnSO4 + H2O H2C2O4 2CO2˚
H2SO4
FeSO4 Fe2(SO4)3
H2SO4
Na2SO3 Na2SO4
В таблице в рамку заключены исходные вещества. За рамкой показаны продукты реакции.
Окислительные свойства калия дихромата.
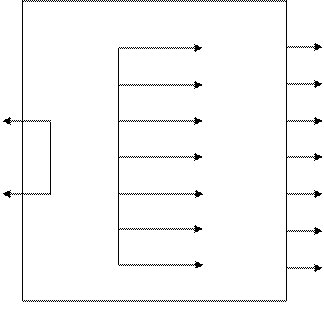 HCI CI2˚
HCI CI2˚
H2SO4
H2S S˚
H2SO4
KCI + CrCI3 + H2O KI I2˚
H2SO4
K2Cr2O7 H2O2 O2˚
H2SO4
K2SO4 + Cr2(SO4)3 + H2O H2C2O4 2CO2˚
H2SO4
FeSO4 Fe2(SO4)3
H2SO4
Na2SO3 Na2SO4
 2015-07-21
2015-07-21 2393
2393








