Для осуществления процесса кристаллизации в растворе необходимо создать пересыщение. По способам его создания различают два основных метода кристаллизации: охлаждение горячих насыщенных растворов (изогидрическая или политермическая кристаллизация) и удаление части растворителя путем выпаривания (изотермическая кристаллизация).
Политермическая кристаллизация. Растворимость большинства веществ уменьшается с понижением температуры. Поэтому при охлаждении горячих растворов возникает пересыщение, обусловливающее выделение кристаллов. Этот метод также получил название изогидрической кристаллизации, поскольку при его осуществлении количество растворителя (например, воды) остается постоянным.
На диаграмме растворимости (рисунок 9.1) охлаждение горячего ненасыщенного раствора, имеющего температуру t1 и концентрацию C 1 (точка А), до конечной температуры t2 условно можно изобразить линией АС, которая пересекает кривую растворимости в точке В, характеризующей насыщенное состояние раствора при температуре t1'. Если кристаллизация раствора начинается только после его охлаждения до температуры t2, при которой и заканчивается полное снятие пересыщения, то процесс кристаллизации изобразится линией CD, а конечное состояние раствора – точкой D на кривой растворимости, соответствующей равновесной концентрации C 2.
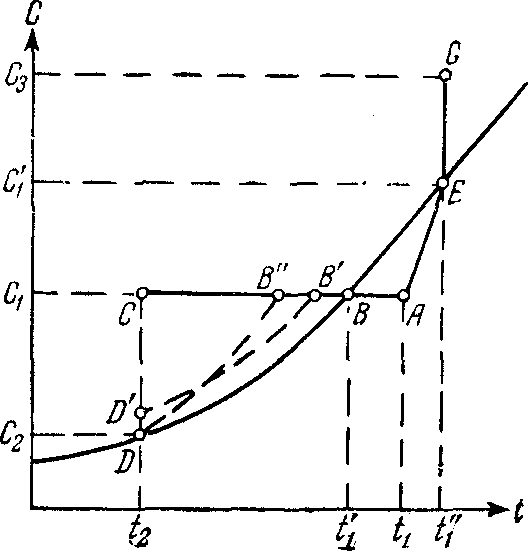
Рис. 9.1. Диаграмма растворимости
В том случае, если раствор не способен к образованию сколько-нибудь заметного пересыщения, процесс его охлаждения и кристаллизации изобразится линией АВD. В зависимости от скорости охлаждения раствора и его способности образовывать пересыщение реальный процесс может протекать также по линиям AB'D'D или AB"D.
Изотермическая кристаллизация. Перевод исходного раствора, характеризуемого точкой А (рисунок 9.1), в пересыщенное состояние можно осуществить и за счет частичного удаления растворителя при выпаривании раствора. Такой метод получил название изотермической кристаллизации, так как выпаривание насыщенного раствора происходит при постоянной температуре его кипения.
Изменение концентрации исходного ненасыщенного раствора при выпаривании изобразится линией AEG, которая показывает, что с повышением концентрации раствора соответственно возрастает и его температура кипения. Только после перехода раствора в насыщенное состояние при концентрации С 1' (точка Е) температура уже больше не меняется и остается равной t1''.
Понятно, что приведенное выше изображение процесса кристаллизации по линии AEG на диаграмме растворимости является условным, и точка G характеризует лишь общее пересыщение раствора, которое может быть получено при удалении из него определенной части растворителя. В большинстве случаев кристаллизация раствора при выпаривании протекает при постоянной концентрации, очень близкой к состоянию насыщения для данной температуры t1''.
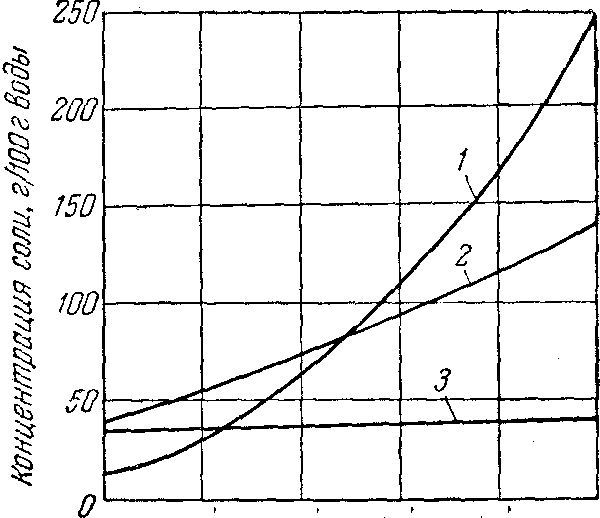
Выбор того или иного метода кристаллизации зависит, в первую очередь, от характера изменения растворимости вещества при различной температуре. Для солей, растворимость которых резко уменьшается с понижением температуры, целесообразной является изогидрическая кристаллизация. В этом случае даже при сравнительно небольшом охлаждении раствора из него будет выделяться значительное количество соли (рисунок 9.2, кривая растворимости KNO3). Именно изогидрической кристаллизацией получают большинство солей с резко выраженной прямой растворимостью (NaNO3, К2Сr2О7, NH4C1, CuSO4×5H2O).
Рис.9.2. Кривые растворимости в воде КNО3 (1), Ва(NО3)2 (2)
и NaCl (3)
В тех случаях, когда растворимость соли почти не меняется при изменении температуры, кристаллизация охлаждением становится неэффективной и применяется изотермическая кристаллизация Кривая растворимости, например NaCl показывает, что при охлаждении насыщенного раствора из него выпадает лишь очень небольшое количество соли, поэтому кристаллизация NaCI проводится всегда выпариванием.
Изотермическая кристаллизация применяется также для солей с обратной растворимостью, например для Na2SO4, растворимость которого, начиная с 32,40С, уменьшается с повышением температуры. Для кристаллизации солей с резко выраженной обратной растворимостью иногда используют просто нагревание раствора до высоких температур. Так, например, получают безводный кристаллический сульфит натрия Na2SO3и сульфат марганца MnSO4.
На практике в ряде случаев комбинируют рассмотренные выше методы создания пересыщения. Так, при вакуум-кристаллизации раствор охлаждается за счет адиабатического испарения части растворителя. Этот метод кристаллизации особенно эффективен для солей, растворимость которых сравнительно плавно уменьшается с понижением температуры.
Частичное испарение растворителя характерно и для некоторых кристаллизаторов охладительного типа, например, для башенных кристаллизаторов, барабанных с воздушным охлаждением, качающихся и других.
Кристаллизация высаливанием. При добавлении к раствору вещества, понижающего растворимость выделяемой соли, можно вызвать пересыщение раствора и кристаллизацию. Подобный метод кристаллизации получил название высаливания.
Вещества, добавляемые в раствор, обычно имеют одинаковый ион с кристаллизуемой солью. Характерными примерами процессов высаливания являются: кристаллизация железного купороса из травильных растворов при добавлении в них концентрированной серной кислоты, высаливание NaCl из рассолов за счет введения в них хлористого магния или хлористого кальция; получение безводного сульфата натрия добавлением к его растворам NaCl; высаливание поваренной солью хлористого бария из гидросульфидных щелоков.
Высаливающее вещество лучше вводить в раствор в виде насыщенного раствора, так как при добавлении твердого высаливателя на нем может осаждаться кристаллизующаяся соль, что вызовет замедление или даже прекращение растворения осадителя.
В некоторых случаях для выделения соли к раствору добавляют вещества, понижающие растворимость кристаллизуемой соли. Так, для высаливания сульфата натрия из водного раствора можно использовать аммиак, метиловый или этиловый спирты. Аналогично кристаллизуют железный купорос из травильных растворов при добавлении ацетона.
Введение органических растворителей в водные растворы неорганических солей увеличивает эффективность процесса кристаллизации, обеспечивая высокую степень извлечения соли из раствора и возможность получения продукта в чистом виде. Недостатком этого способа является сравнительно высокая стоимость органических растворителей, регенерация которых требует проведения дополнительных операций (например, ректификации и дистилляции) и связана с некоторой потерей реагента.
Кристаллизация в результате химических реакций. Пересыщение можно создать за счет проведения химических реакций. Образующееся в результате вещество выделяется в виде кристаллической фазы из раствора. Такой химический метод кристаллизации используется в аналитической практике, а также в ряде технологических схем.
Так, например, при очистке природных и сточных вод чаще всего проводят кристаллизацию карбонатов, сульфатов и гидроокисей металлов, обладающих незначительной растворимостью. Использование при очистке кристаллизации труднорастворимых соединений обусловлено главным образом одной причиной – полнотой осаждения. Следует, однако, отметить, что в определенных условиях остаточные пересыщения при кристаллизации труднорастворимых соединений могут быть значительными. Наблюдаемая картина связана с особой способностью таких веществ образовывать устойчивые пересыщенные растворы.
Так как пересыщенные растворы веществ с малой растворимостью образуются в результате химических реакций, в принципе можно добиться очень большого исходного пересыщения. Следовательно, одной из отличительных черт осаждения труднорастворимых соединений является то, что они кристаллизуются в широком интервале пересыщений, а это дает возможность проводить процесс фазообразования в самых разнообразных вариантах. Создавая различные исходные пересыщения, можно вести осаждение и очень быстро, и очень медленно, получая при этом осадки разнообразного гранулометрического состава. От скорости кристаллизации в свою очередь зависят конечные размеры и форма кристаллов.
За счет проведения химической реакции в коксохимическом производстве получают кристаллический сульфат аммония при нейтрализации растворов серной кислоты аммиаком, содержащимся в коксовом газе. В сатураторах, используемых для этой цели, протекает следующая реакция (9.3):
2NH3 + H2SO4 → (NH4)2SO4. (9.3)
В производстве кальцинированной соды промежуточный продукт (бикарбонат натрия NaHCO3) также получают вследствие химической реакции, протекающей при абсорбции аммиачно-соляным раствором двуокиси углерода. Эта реакция может быть выражена суммарным уравнением (9.4):
NaCl + NH3 + CO2 + H2O → NaHCO3 + NH4Cl. (9.4)
В образующемся растворе наименее растворимой солью является бикарбонат натрия, который выпадает в виде кристаллического осадка и служит для получения кальцинированной соды.
Другими способами получения кристаллических продуктов в результате химических реакций являются: кристаллизация хлористого аммония при нейтрализации газообразным аммиаком водных растворов NH4C1, насыщенных хлористым водородом; осаждение мелкокристаллического сульфата бария при обработке растворов солей бария (например, BaCl2) серной кислотой или сернокислыми солями (например, Na2SO4); кристаллизация нитрата бария при сливании насыщенных растворов хлористого бария и азотнокислого аммония.
Процесс кристаллизации из растворов включает две стадии: образование кристаллических зародышей и их дальнейший рост.
Первой теорией, количественно описывающей образование кристаллических зародышей, явилась теория М. Фольмера. Однако М. Фольмер в своих работах не рассматривает механизм образования зародышей. Эта часть его теории была разработана И.Н. Странским и Р. Каишевым, предложившим молекулярно-кинетическую теорию образования кристаллических зародышей. В её основу положено представление Гиббса о скачкообразном росте кристаллов в отличие от роста изотропных капель. По мнению авторов, процесс образования центра кристаллизации проходит три ступени. Вначале будущему зародышу энергетически «выгоднее» расти как «одномерному» – в виде цепочки, затем он растёт как «двухмерный» – в виде пластины, после чего, достигнув определённой величины, становится «трёхмерным», то есть объёмным.
П.В. Грушевицкий, принимая данную схему, считает возможным такие пути процесса, при которых одномерные зародыши могут соединяться между собой в двухмерные, а затем в результате столкновения этих образований непосредственно объединяются в трёхмерные. Также существуют мнения, что образование зародышей должно происходить путём одновременного столкновения такого количества элементарных частиц, обладающих пониженной кинетической энергией, которого будет достаточно для образования кристалла критического размера.
Очень вероятно, что первым этапом возникновения устойчивого зародыша является образование гелеподобной частицы критического размера, в которой уже затем происходит упорядочение структуры, характерной для данного вещества.
После возникновения в условиях пересыщенного раствора устойчивых зародышей на их поверхности начинает отлагаться растворённое вещество. Величина линейной скорости роста кристалла является основной характеристикой этой второй стадией кристаллизации.
Следует отметить, что разграничение процесса на две стадии считается в известной степени условным. Во-первых, общим для обеих стадий является то, что механизм образования устойчивых центров кристаллизации включает и этапы роста субмикроскопических зародышей. Во-вторых, в условиях массовой кристаллизации обе стадии протекают одновременно, их невозможно разграничить во времени. Лишь в очень редких случаях при соблюдении специальных условий, например, при выращивании монокристаллов, можно наблюдать их «чистый» рост.
Тесная связь между образованием зародышей и их ростом, невозможность чёткого разграничения этих этапов затрудняют изучение процессов кристаллизации. Этим, по-видимому, и объясняется, что ни одна из предложенных теорий роста кристаллов не может считаться исчерпывающей для объяснения всех особенностей такого сложного гетерогенного процесса.
Наиболее важными теориями роста кристаллов являются:
– термодинамическая теория Гиббса – Кюри – Вульфа;
– диффузионная теория;
– молекулярно-кинетическая теория послойного роста кристаллов.
На размеры кристаллов оказывают влияние следующие факторы:
– пересыщение раствора – при очень малых пересыщениях кристалл растёт, главным образом, в результате присоединения отдельных ионов или молекул к местам нарушений кристаллической решётки. Однако при этом, несмотря на малое пересыщение раствора, возможен рост кристалла и через двухмерные зародыши. Пересыщение оказывает влияние и на форму образующихся кристаллов. С уменьшением степени пересыщения раствора происходит нивелировка скоростей роста отдельных граней кристалла, и он оказывается огранённым большим числом плоскостей, более равномерно развитых. С увеличением степени пересыщения увеличивается разница в скоростях роста отдельных граней, а также общая скорость роста кристалла за счёт увеличения толщины нарастающих слоёв и повышения частоты их появления на грани. При ещё большем пересыщении наряду с послойным и молекулярно-диффузионным ростом становится возможным так называемый «блоковый» рост кристалла в результате присоединения к нему целых групп определённым образом ориентированных ионов или молекул, размеры которых могут колебаться в широком интервале – от трёхмерных зародышей до микроскопических размеров. Действительно, поскольку пересыщенные растворы рассматриваются как гетерогенные системы, необходимо принять, что с увеличением пересыщения раствора в нем быстро возрастает концентрация субмикрозародышей – блоков, их столкновения, притяжение друг к другу, и особенно к поверхности растущего кристалла, становятся всё более вероятными и частыми;
– перемешивание раствора – при перемешивании раствора обеспечивается равномерный приток кристаллизующегося вещества к различным граням, тем самым устраняется влияние концентрационных потоков, что способствует образованию кристаллов правильной формы. При массовой кристаллизации перемешивание раствора препятствует осаждению кристаллов на дне и стенках сосуда и предупреждает тем самым возможность друзового роста. Кроме того, с повышением интенсивности перемешивания кристаллизуемого раствора уменьшается агрегированный рост кристаллов, которые постепенно приобретают всё более правильную форму;
– влияние температуры – повышение температуры кристаллизации резко увеличивает скорость роста кристаллов, что непосредственно вытекает из общих положений теории кристаллизации;
– влияние растворимых примесей – присутствие в растворе даже ничтожно малого количества примесей может оказать существенное влияние на скорость роста отдельных граней кристалла, его форму, окраску, однородность. Некоторые примеси могут полностью приостановить рост кристалла даже при значительном пересыщении раствора. Другие, наоборот, могут вызвать укрупнение кристаллов в процессе массовой кристаллизации. Существенное влияние на форму кристаллов, выделяющихся из водных растворов, оказывают органические соединения, являющиеся поверхностно-активными веществами.
Конечный размер кристаллов при массовой кристаллизации зависит от соотношения скоростей образования зародышей и их последующего роста. Если скорость возникновения зародышей значительно превышает скорость их роста, то в процессе кристаллизации образуются мелкокристаллические осадки. Если же основная масса кристаллизующегося вещества отлагается на поверхности первоначально возникших зародышей, а в последующем новые центры кристаллизации не образуются или образуются в очень малом количестве, то в результате будет образовываться крупнокристаллический продукт. В производственных условиях обычно стремятся получать крупнокристаллический, по возможности однородный продукт и лишь в редких случаях – мелкие кристаллы.
 2015-08-21
2015-08-21 6946
6946
