Совокупность стадий, через которые протекает химическая реакция называется механизмом реакции. Синтез HI включает две стадии:
1. Образование АК. При этом затрачивается энергия. ∆Е = 198 кДж/моль.
2. Распад АК на две молекулы HI. При этом выделяется энергия. ∆Е = -171 кДж/моль.
Первая стадия менее выгодна по энергии, значит менее вероятна и идет с меньшей скоростью. Скорость сложного процесса будет определяться самой медленной стадией, которая называется лимитирующей. Поэтому подбирают такие способы получения вещества, чтобы их скорость была максимальна. Одним из таких способов является использование катализаторов.
Все реакции можно подразделить на простые и сложные. Простые реакции протекают в одну стадию и называются одностадийными. Сложные реакции идут либо последовательно (многостадийные реакции), либо параллельно, либо последовательно—параллельно. В свою очередь, в каждой стадии реакции может участвовать одна молекула (мономолекулярные реакции), две молекулы (бимолекулярные реакции) и три молекулы (тримолекулярные реакции).
|
|
|
Число молекул реагента, принимающих участие в простейшей (элементарной) стадии, называется ее молекулярностью.
Одностадийные реакции. Относительно небольшое число реакций протекает в одну стадию. К одностадийным реакциям, например,
относятся:
реакции диссоциации
Н2 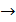 2Н, С12
2Н, С12 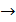 2С1, 2HI
2С1, 2HI 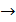 Н2 +l2.
Н2 +l2.
взаимодействие иода и водорода
I + Н2 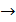 2HI
2HI
взаимодействие моноксида азота с водородом и озоном
2NO + Н2 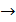 N20 + Н20
N20 + Н20
NO + O3 = N0 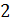 + 0
+ 0 
Сложные реакции. К сложным относятся реакции, протекающие последовательно через несколько стадий, или параллельно. Большинство реакций являются многостадийными.
Если одна из этих стадий протекает значительно медленнее других, то эта стадия будет определять скорость всего процесса, и ее называют лимитирующей стадией.
Обычно лимитирующая стадия записывается как необратимая реакция, а другие стадии как обратимые реакции. Например:
N2O2 ↔NO2 + NO3 (быстрая реакция)
NO2 + NO3 → NO2 + NO + O2 (медленная реакция)
NO + NO3 ↔ 2NO2 (быстрая стадия)
Лимитирующая вторая стадия.
8) Катализом называется явление изменения скорости реакции под действием некоторых веществ (катализаторами) и не входящими в стехиометрическое уравнение реакции, которые участвуют в процессе, но к концу реакции остаются неизменными. Катализ называется положительным, если скорость реакции увеличивается и отрицательным, если уменьшается, при добавлении катализатора. В присутствии катализатора образуется другой АК (активированный комплекс) с меньшей ЕА (энергия активации реакции) и реакция ускоряется.
Св-ва катализатора:
|
|
|
-Катализатор ускоряет только термодинамически возможные реакции
-Катализатор в ходе реакции сохраняет количество и химический состав, но не физическое состояние
-В равной степени ускоряет прямую и обратную реакции, следовательно не смещает равновесие
-Разные катализаторы с одним и теми же исходными веществами образуют разные АК, значит могут образовывать разные продукты реакции, это свойство называется- селективностью катализатора.
9). При гомогенном катализе молекулы реагирующих веществ и катализатора находятся в одной фазе (жидкой или газооб.), в которой образуют АК.
10). При гетерогенном катализе ускорение процесса обычно происходит на поверхности твердого тела — катализатора, поэтому активность катализатора зависит от величины и свойств его поверхности. На практике катализатор обычно наносят на твердый пористый носитель.
 2015-08-21
2015-08-21 7222
7222
