Термодинамическая активность - величина, позволяющая представлять в удобной для практич. использования форме концентрац. зависимость хим. потенциалов компонентов реального р-ра. С помощью этой величины можно применять к реальному р-ру термодинамич. соотношения, относящиеся к идеальному р-ру, если заменить в них концентрации активностями. Отношение активности компонента к его концентрации наз. коэф. активности. Хим. потенциали активность а,- i-того компонента р-ра по определению связаны соотношением: где R-газовая постоянная, T - т-ра,-хим. потенциал компонента в определенным образом выбранном стандартном состоянии. Значениязависят только от T и давления р; ai - ф-ция Т, р и состава р-ра. Т. обр., введение понятия активности позволяет разделить выражение для хим. потенциала на две части: постоянную при данных Т и ри зависящую от состава (RTlnai). Это разделение условно, поскольку численное значение ai зависит от выбора стандартного состояния. В стандартном состоянии ai = 1. Для компонентов жидких р-ров неэлектролитов чаще всего в кач-ве стандартного выбирают состояние чистой жидкости при т-ре и давлении р-ра с хим. потенциалом (Т, р). Тогда=при мольной доле Ni = 1, активность ai и коэф. активности=ai/Ni равны единице. В р-ре Если р-р ведет себя как идеальный, тоид =+ RT1nNi. Знак разности—нд = RT\n определяет знак отклонения поведения реального р-ра от идеального: при > 1 отклонение от идеальности положительно, при < 1 - отрицательно. Выбор чистых в-в в качестве стандартных состояний для всех компонентов р-ра наз. симметричной нормировкой активностей; ее применяют в тех случаях, когда все компоненты р-ра рассматриваются как равноправные. При т. наз. несимметричной нормировке активностей стандартным состоянием для р-рителя (компонент 1) служит чистая жидкость 1, как и при симметричной нормировке, = 1 при Ni = 1. Для растворенного в-ва (компонент 2) принимают, что его активность совпадает с концентрацией и коэф. активности равен единице в предельно разб. р-ре
Коэффициент активности – коэффициент, связывающий реальную концертрацию электролита с его термодинамической активностью в уравнении a = γc (a – активность; с – концентрация; γ – коэффициент активности). Чтобы уравнения для идеальных растворов не меняли вид, в них используются активности. Для определения коэффициентов активности используются различного вида приближения, в основе которых лежит предельный закон Дебая-Хюккеля.
|
|
|
Сам по себе предельный закон Дебая-Хюккеля имеет ограниченное применение в области сильно разбавленных растворов, поэтому чаще пользуются различными усовершенствованными приближениями.
|
|
|
Одной из форм приближения является формула: lg γ± = — A |z+z–|I½ / (1 + I½) + CI,
где γ± – среднеионной коэффициент активности; A – константа, зависящая от диэлектрической проницаемости среды и от температуры; I – ионная сила раствора; C – эмпирическая константа, обычно принимаемая значение -0.1.
Активности всех компонентов р-ра связаны между собой Гиббса-Дюгема уравнением Nidlnai, = 0 (при постоянных Т и р).
Экспериментальные методы определения активности компонентов в растворе основаны на изучении какого-либо гетерогенного равновесия в системе. При рассмотрении этих методов следует помнить, что в условиях равновесия химические потенциалы i-го компонента в разных фазах (I и II) равны: 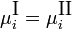
Это соотношение является исходной точкой для вывода расчетных уравнений в некоторых из методов определения активности. Кроме того, активности компонентов в некоторой фазе связаны между собой уравнением: 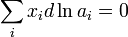
По равновесному давлению пара В основе этого метода лежит соотношение: 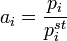
где 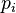 — парциальное давление пара компонента над раствором, а
— парциальное давление пара компонента над раствором, а 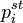 — давление пара этого компонента для стандартного состояния (см. выше). Соответственно, если за стандартное состояние принято состояние чистого компонента, то
— давление пара этого компонента для стандартного состояния (см. выше). Соответственно, если за стандартное состояние принято состояние чистого компонента, то 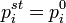 .
.
По повышению температуры кипения раствора Температура кипения раствора 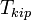 выше температуры кипения чистого растворителя
выше температуры кипения чистого растворителя 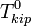 . Данные об изменении температуры кипения раствора могут быть использованы для расчета активности растворителя, в соответствии с уравнением:
. Данные об изменении температуры кипения раствора могут быть использованы для расчета активности растворителя, в соответствии с уравнением: 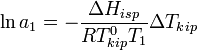 , где
, где 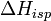 — теплота испарения растворителя, в интервале от температуры кипения чистого растворителя до температуры кипения раствора принимаемая постоянной. Индексом «1» обычно обозначается растворитель.
— теплота испарения растворителя, в интервале от температуры кипения чистого растворителя до температуры кипения раствора принимаемая постоянной. Индексом «1» обычно обозначается растворитель.
По понижению температуры замерзания раствора Температура замерзания раствора 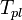 ниже температуры замерзания чистого растворителя
ниже температуры замерзания чистого растворителя 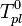 . Соответственно, активностьрастворителя можно рассчитать, используя зависимость:
. Соответственно, активностьрастворителя можно рассчитать, используя зависимость: 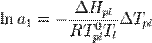 , где
, где 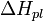 — теплота плавления растворителя.
— теплота плавления растворителя.
По осмотическому давлению раствора Величина осмотического давления раствора может быть использована для определения активности растворителя в соответствии с соотношением: 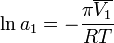
где 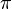 — осмотическое давление,
— осмотическое давление, 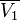 — парциальный молярный объём растворителя.
— парциальный молярный объём растворителя.
 2015-08-12
2015-08-12 8655
8655
