Для химической реакции:
2 NO(г) + O2(г)  2 NO2(г)
2 NO2(г)
константа химической реакции Кс есть отношение:
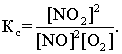 В этом уравнении в квадратных скобках – концентрации реагирующих веществ, которые устанавливаются при химическом равновесии, т.е. равновесные концентрации веществ.
В этом уравнении в квадратных скобках – концентрации реагирующих веществ, которые устанавливаются при химическом равновесии, т.е. равновесные концентрации веществ.
Константа химического равновесия связана с изменением энергии Гиббса уравнением:
 GTо = – RTlnK.
GTо = – RTlnK.
11) Оксиды – соединения элемента с кислородом.
Оксиды не образующие кислот, оснований и солей при обычных условиях, называются не солеобразующими.
Солеобразующие оксиды подразделяются на кислотные, основные и амфотерные (обладающие двойственными свойствами). Неметаллы образуют только кислотные оксиды, металлы – все остальные и некоторые кислотные.
Получение -горение(окисление)сложных и простых, разложение сложных кислородосожержащих, кислот и слабых кислот, средних солей, кислых солей, основных солей. Свойства -растворимые в воде взаимодействуют с ней, кислотные образуют кислоты, основные щелочи.2)основные взаим. с кислотами3)оксиды щелочных и зем.щел. металлов взаимод. с амфотерными4)основные взаим. с кислотами5)кислотные + щелочные.
Основания – сложные вещества, молекулы которых состоят из атома металла и одной или нескольких гидроксогрупп, способных замещаться на кислотный остаток. Растворимые нерастворивые(амфотерные и типичные) Получение 1)взаимодействием металла с водой2)оксиды + вода3)нерасворимые основания=щелочи+соотв соли. Свойства -1)щелочи и осн взаим с кислотами2)щелочи реагируют с нераств солями3)реагируют с амфотерными основаниями4)неметаллы взаим с щелочами
Кислоты – сложные вещества, содержащие атомы водорода, которые могут замещаться катионами металла (или ионами аммония). Основность- способность диссоциировать. Получение. 1)безкислородн. Получают взаимод элементов(прямой синтез)2)действую на их соли более сильных и менее летучих кислот3)растворение в воде оксида Свойства кислот. 1)кислоты разбавленные и неокислители взаим с металлами стоящими в ряду активности до Н.2)кислоты взаимод с основными оксидами3)кислоты+амфотерные оксиды.
Соли – продукты замещения (полного или частичного) атомов водорода в молекулах кислот катионами металла (а также ионами аммония), либо гидроксогрупп в молекулах оснований кислотными остатками.
Соли делятся на средние, кислые, основные, двойные, смешанные и комплексные. Получение 1)металл+сера2)металл+ кислота3)амфот металл+щелочь4)основания+кислоты5)основание+кислотн оксид6)основание+кислота7)соль+щелочь8)соль + кислота9)соль+соль Свойства. 1)диссоциация2)взаимодействие и индикаторами3)разложение при нагревании4)взаимодействие с кислотами5)взаим с щелочами6)взаим. Друг с другом8)электролиз9)взаим с кислотн оксидами.
12) Степенью окисления атома называется фактическая либо кажущаяся величина электростатического заряда атома в простом веществе, в молекуле химического соединения, в ионе.
Окислительно-восстановительные реакции – это реакции, в ходе которых происходит изменение степени окисления элементов.
 2015-08-21
2015-08-21 950
950








