Проведенное выше рассмотрение позволяет получить и распределение молекул газа по величине скорости. Теперь нас будет интересовать число молекул 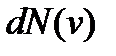 газа, скорости которых заключены в интервале от v до v + dv. Поскольку каждому значению скорости соответствует одно значение кинетической энергии, то число молекул со скоростями в интервале от v до v + dv будет равно числу молекул с кинетической энергией в интервале от
газа, скорости которых заключены в интервале от v до v + dv. Поскольку каждому значению скорости соответствует одно значение кинетической энергии, то число молекул со скоростями в интервале от v до v + dv будет равно числу молекул с кинетической энергией в интервале от 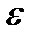 до
до 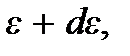 т.е.
т.е. 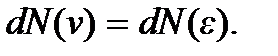 Поэтому искомое число молекул
Поэтому искомое число молекул 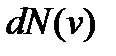 можно получить, если в формуле (3.14) вместо кинетической энергии частицы
можно получить, если в формуле (3.14) вместо кинетической энергии частицы 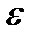 подставить ее выражение
подставить ее выражение 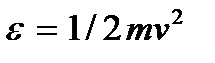 и учесть, что
и учесть, что 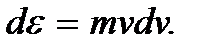 Будем иметь
Будем иметь
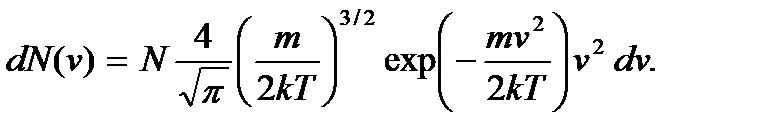 (3.17)
(3.17)
Полученное соотношение называют распределением Максвелла по модулю скорости молекул идеального газа, а функцию
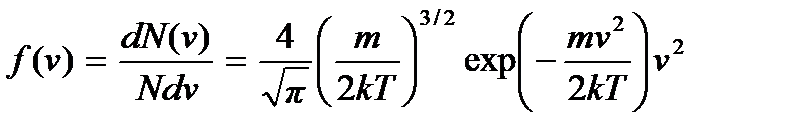 (3.18)
(3.18)
– функцией распределения Максвелла по скоростям молекул газа. Величина 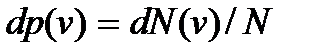 определяет вероятность иметь молекуле значение скорости, заключенное в интервале от v до v + + dv. Поэтому функция
определяет вероятность иметь молекуле значение скорости, заключенное в интервале от v до v + + dv. Поэтому функция 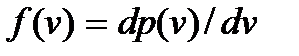 определяет плотность указанной вероятности.
определяет плотность указанной вероятности.
График функции распределения 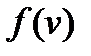 для двух значений температур T 1 и
для двух значений температур T 1 и 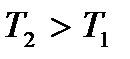 показан на рис. 3.4.
показан на рис. 3.4.
|
|
|
Как видим, кривая 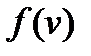 при некотором значении скорости
при некотором значении скорости 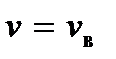 имеет максимум. Это означает, что с наибольшей вероятностью в газе можно обнаружить молекулу с этим значением скорости, поэтому ее называют наиболее вероятной скоростью. Из условия максимума
имеет максимум. Это означает, что с наибольшей вероятностью в газе можно обнаружить молекулу с этим значением скорости, поэтому ее называют наиболее вероятной скоростью. Из условия максимума 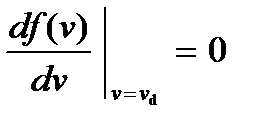 находим
находим
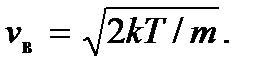
Видим, что величина наиболее вероятной скорости зависит от массы m молекулы и от температуры газа T.
При удалении от точки максимума кривая  как и кривая
как и кривая  спадает как в сторону больших, так и в сторону малых скоростей, причем, в отличие от кривой
спадает как в сторону больших, так и в сторону малых скоростей, причем, в отличие от кривой 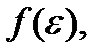 эта кривая спадает в сторону больших скоростей медленнее, чем в сторону малых. Это означает, что слишком большие и слишком малые значения скорости и кинетической энергии молекул в газе крайне редки. Абсолютные значения скорости и кинетической энергии молекул в основном находятся в некотором интервале вблизи наиболее вероятного значения. С увеличением температуры максимум кривой
эта кривая спадает в сторону больших скоростей медленнее, чем в сторону малых. Это означает, что слишком большие и слишком малые значения скорости и кинетической энергии молекул в газе крайне редки. Абсолютные значения скорости и кинетической энергии молекул в основном находятся в некотором интервале вблизи наиболее вероятного значения. С увеличением температуры максимум кривой 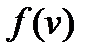 сдвигается в сторону больших скоростей. Изменяется и форма кривой. Она становится более пологой, возрастает число быстрых молекул и уменьшается число медленных. Высота максимума снижается; распределение по скоростям становится более равномерным. Площадь под кривой сохраняет свое значение, равное единице.
сдвигается в сторону больших скоростей. Изменяется и форма кривой. Она становится более пологой, возрастает число быстрых молекул и уменьшается число медленных. Высота максимума снижается; распределение по скоростям становится более равномерным. Площадь под кривой сохраняет свое значение, равное единице.
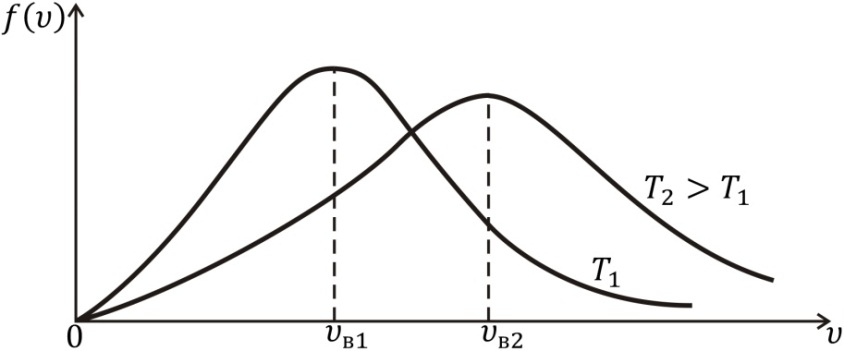
Рис. 3.4
Наиболее вероятная скорость называется второй характеристической скоростью молекулы. Первой такой скоростью является введенная ранее средняя квадратичная скорость. По известному закону распределения (3.17) можно вычислить и третью характеристическую скорость, которой является средняя арифметическая скорость молекулы:
|
|
|
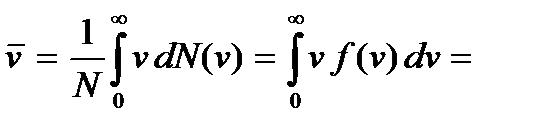
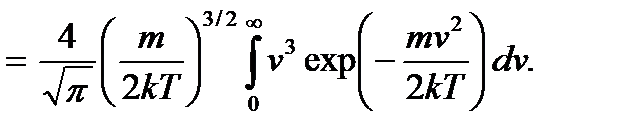
Обозначив 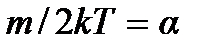 и учтя, что
и учтя, что 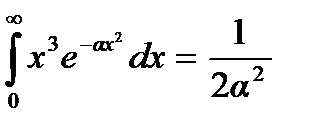 , получим
, получим
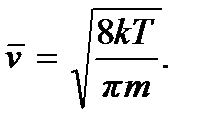
Среднее значение квадрата скорости
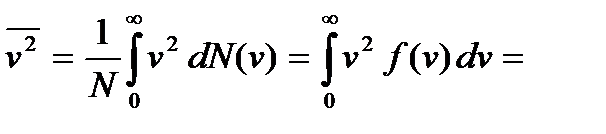
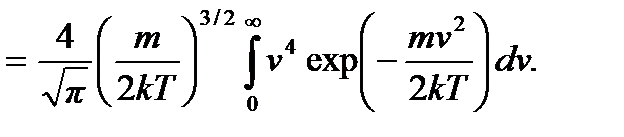
Используя формулу
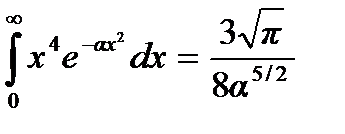 ,
,
получим 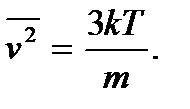 Откуда находим уже введенную выше среднюю квадратичную скорость:
Откуда находим уже введенную выше среднюю квадратичную скорость:
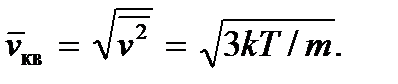
Заметим, что все три характеристические скорости пропорциональны друг другу и мало отличаются друг от друга.
Максвелловское распределение молекул газа по скоростям и кинетическим энергиям является тем распределением, которое устанавливается в газе при тепловом равновесии. К этому распределению газ приходит независимо от того, какое распределение он имел в начальный момент. Процесс установления максвелловского распределения сопровождается, таким образом, полной потерей информации о начальном состоянии газа. Здесь мы встречаемся с ситуацией, совершенно отличной от той, которая имеет место в механике, где начальные значения координат и скоростей системы (т.е. ее начальное состояние) определяют ее координаты и скорости в последующие моменты времени и тем самым по состоянию системы в начальный момент времени можно определить ее последующие состояния. Система «помнит» свое начальное состояние. В газе же, каким бы ни было начальное распределение скоростей, с течением времени это распределение превращается в распределение Максвелла. Если система не сохранила никакой информации о своем предшествующем состоянии, говорят, что в системе имеет место молекулярный хаос. Следовательно, состояние теплового равновесия является состоянием молекулярного хаоса. Установившись в газе, это распределение при молекулярных движениях и взаимных столкновениях уже не меняется с течением времени. Можно сказать, что состояние с установившимся распределением по скоростям и является состоянием теплового равновесия. Состояние с установившимся распределением может быть нарушено только при изменении внешних условий – давления, температуры и т.д. Но, как показал Больцман, если после этого газ предоставить самому себе, то в результате столкновений между молекулами в газе вновь установится распределение Максвелла, соответствующее этим новым условиям.
 2015-09-06
2015-09-06 3787
3787
