PV= 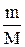 RT
RT
получим плотность:
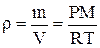 .
.
Откуда, подставив численные значения, имеем:
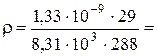 0,16·10-13 кг/м3.
0,16·10-13 кг/м3.
Пример 3. Найти молярную массу воздуха, считая, что он состоит из одной части кислорода и трех частей азота.
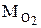 =32×10-3 кг/моль,
=32×10-3 кг/моль, 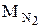 =28×10-3 кг/моль.
=28×10-3 кг/моль.
Решение. Воздух, являясь смесью идеальных газов, тоже представляет собой идеальный газ, и к нему можно применить уравние Менделеева–Клапейрона:
PV= 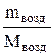 RT. (1)
RT. (1)
Для каждого компонента смеси (кислорода и азота) имеем:
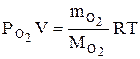 , (2)
, (2)
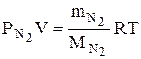 , (3)
, (3)
где 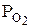 и
и 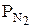 – парциальные давления каждого компонента.
– парциальные давления каждого компонента.
По закону Дальтона
Рвозд = 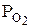 +
+ 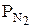 .
.
Сложив (2) и (3), получим
(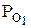 +
+ 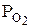 )V =
)V = 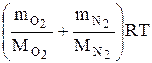 . (4)
. (4)
или на основании закона Дальтона
PV= 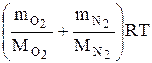 . (5)
. (5)
Сравнив (1) и (5) с учетом того, что mвозд =m 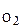 +m
+m 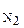 , имеем:
, имеем:
Откуда
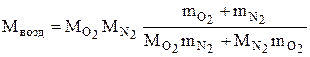 . (6)
. (6)
Подставив в (6) равенство m 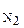 =3m
=3m 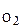 (по условию), найдем молярную массу воздуха:
(по условию), найдем молярную массу воздуха:
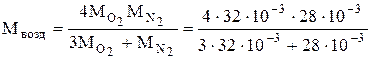 =29×10-3 кг/моль.
=29×10-3 кг/моль.
Пример 4. Плотность некоторого газа равна 6·10-2 кг/м3, а среднеквадратичная скорость молекул – 500 м/с. Найти давление, которое газ оказывает на стенку сосуда.
Решение. В основном уравнении молекулярно- кинетической теории –
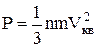 .
.
|
|
|
Произведение nm выражает массу молекул, содержащихся в единице объема вещества, и следовательно, равно плотности ρ газа. Таким образом,
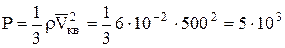 Па.
Па.
Пример 5. 6,5 г водорода, температура которого 270 С, расширяется вдвое при постоянном давлении за счет притока тепла извне. Найти: а) изменение внутренней энергии; б) количество теплоты, сообщенной газу; в) работу расширения. (Мв=2×10-3 кг/моль).
Решение. Вычислим значения молярных теплоемкостей водорода, учитывая, что молекулы водорода – двухатомные, а число i степеней свободы равно пяти:
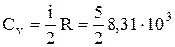 =20,8·103 Дж/моль×К;
=20,8·103 Дж/моль×К;
Cр =Cv + R=20,8·103 + 8,31·103 =29,1·103 Дж/моль×К.
 2015-09-06
2015-09-06 2946
2946








