Так как атом в целом электронейтрален, то количество электронов, дви- жущихся вокруг положительного ядра равно величине заряда ядра. Напри- мер, заряд ядра водорода равен +1, следовательно вокруг ядра движется один электрон; заряд ядра хлора +17, вокруг ядра – 17 электронов; заряд ядра золота +79, вокруг ядра – 79 электронов и т.д.
Возник логический вопрос – по одной и той же орбите движутся, напри- мер, 47 электронов атома серебра или орбит много?
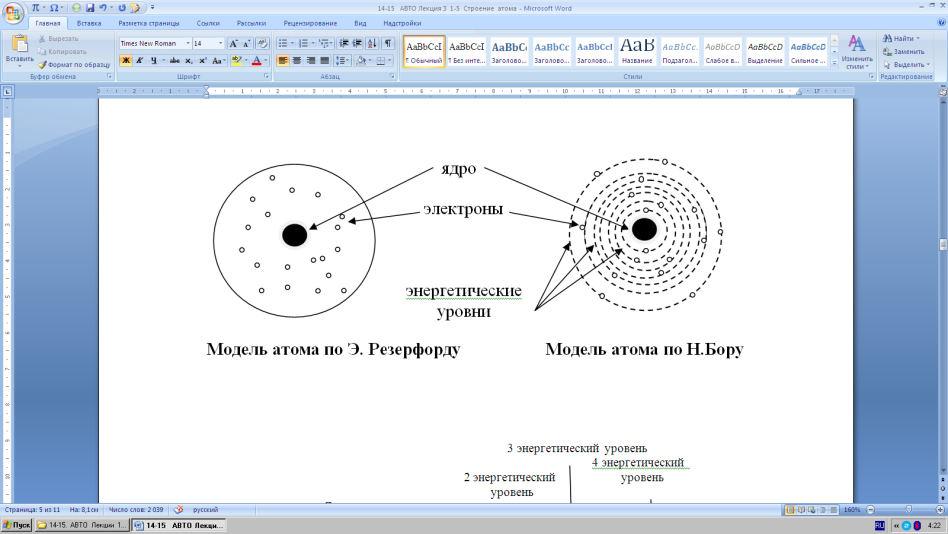
Еще Н.Бор в своей теории строения атома указывал, что в невозбужденном состоянии атома электроны обращаются вокруг ядра по строго определен- ным «разрешенным» круговым орбитам – энергетическим уровням. Таких уровней было открыто семь. Энергетические уровни нумеруются либо араб-
скими цифрами (1, 2, 3, 4, 5, 6, 7), либо латинскими буквами (K, L, M, N, O,
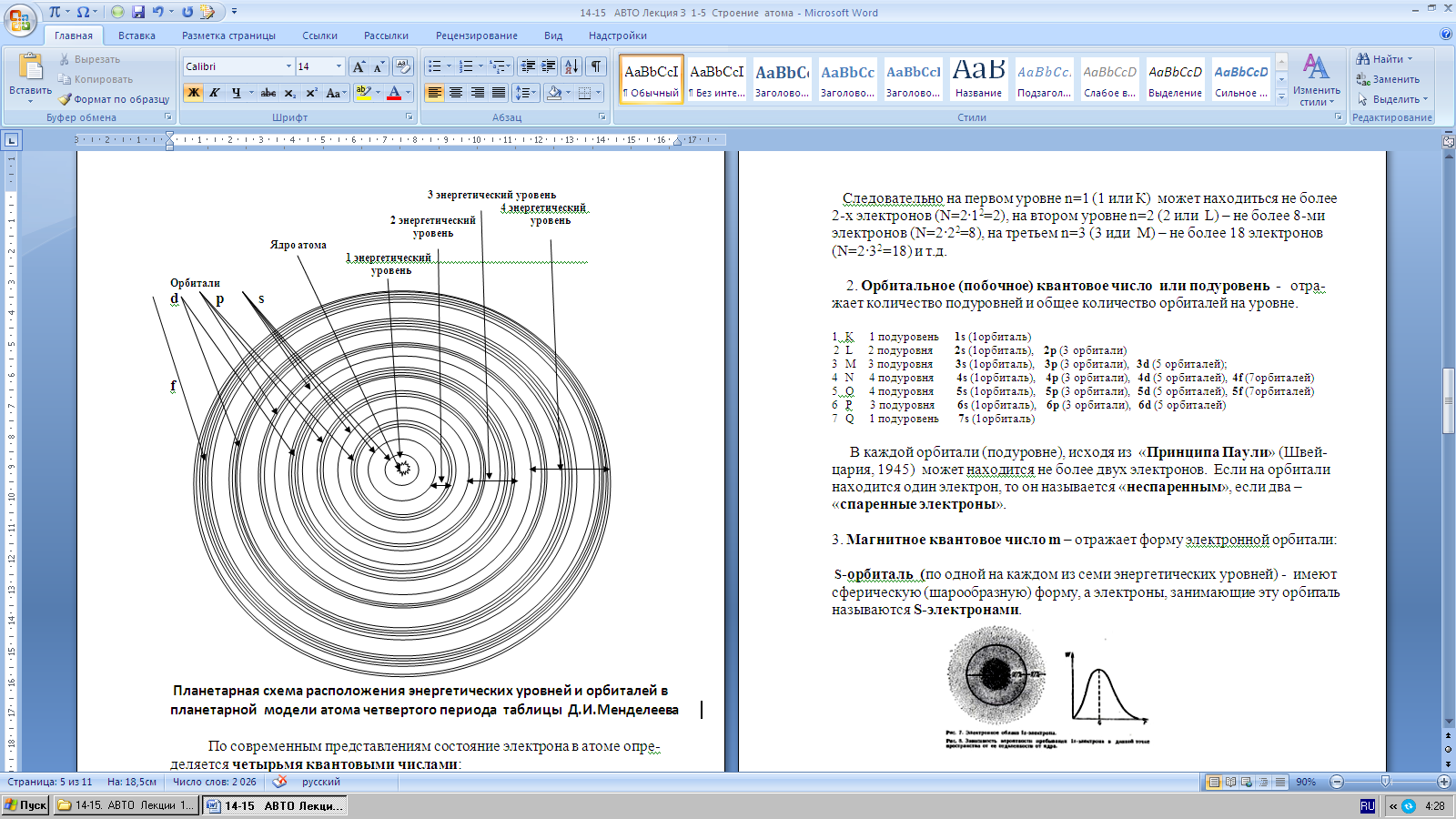 P, Q).
P, Q).
По современным представлениям состояние электрона в атоме опре- деляется четырьмя квантовыми числами:
1. Главное квантовое число n (номер уровня) -номер энергетического уровня
Максимальное количество электронов на том или ином уровне определя- ется по формуле:
|
|
|
N = 2n2 где N – число электронов на уровне
n – номер уровня, считая от ядра
1 К n = 1 N = 2∙12 = 2 электрона
2 L n = 2 N = 2∙22 = 8 электронов
3 M n = 3 N =2∙32 = 18) электронов и т.д.
Следовательно на первом уровне n=1 (1 или К) может находиться не более 2-х электронов (N=2∙12=2), на втором уровне n=2 (2 или L) – не более 8-ми электронов (N=2∙22=8), на третьем n=3 (3 иди М) – не более 18 электронов (N=2∙32=18) и т.д.
2. Орбитальное (побочное) квантовое число или подуровень -отра- жает количество подуровней и общее количество орбиталей на уровне.
1 К 1 подуровень 1s (1орбиталь)
2 L 2 подуровня 2s (1орбиталь), 2p (3 орбитали)
3 М 3 подуровня 3s (1орбиталь), 3p (3 орбитали), 3d (5 орбиталей);
4 N 4 подуровня 4s (1орбиталь), 4p (3 орбитали), 4d (5 орбиталей), 4f (7орбиталей)
5 О 4 подуровня 5s (1орбиталь), 5p (3 орбитали), 5d (5 орбиталей), 5f (7орбиталей)
6 Р 3 подуровня 6s (1орбиталь), 6p (3 орбитали), 6d (5 орбиталей)
7 Q 1 подуровень 7s (1орбиталь)
В каждой орбитали (подуровне), исходя из «Принципа Паули» (Швей- цария, 1945) может находится не более двух электронов. Если на орбитали находится один электрон, то он называется «неспаренным», если два – «спаренные электроны».
3. Магнитное квантовое число m – отражает форму электронной орбитали:
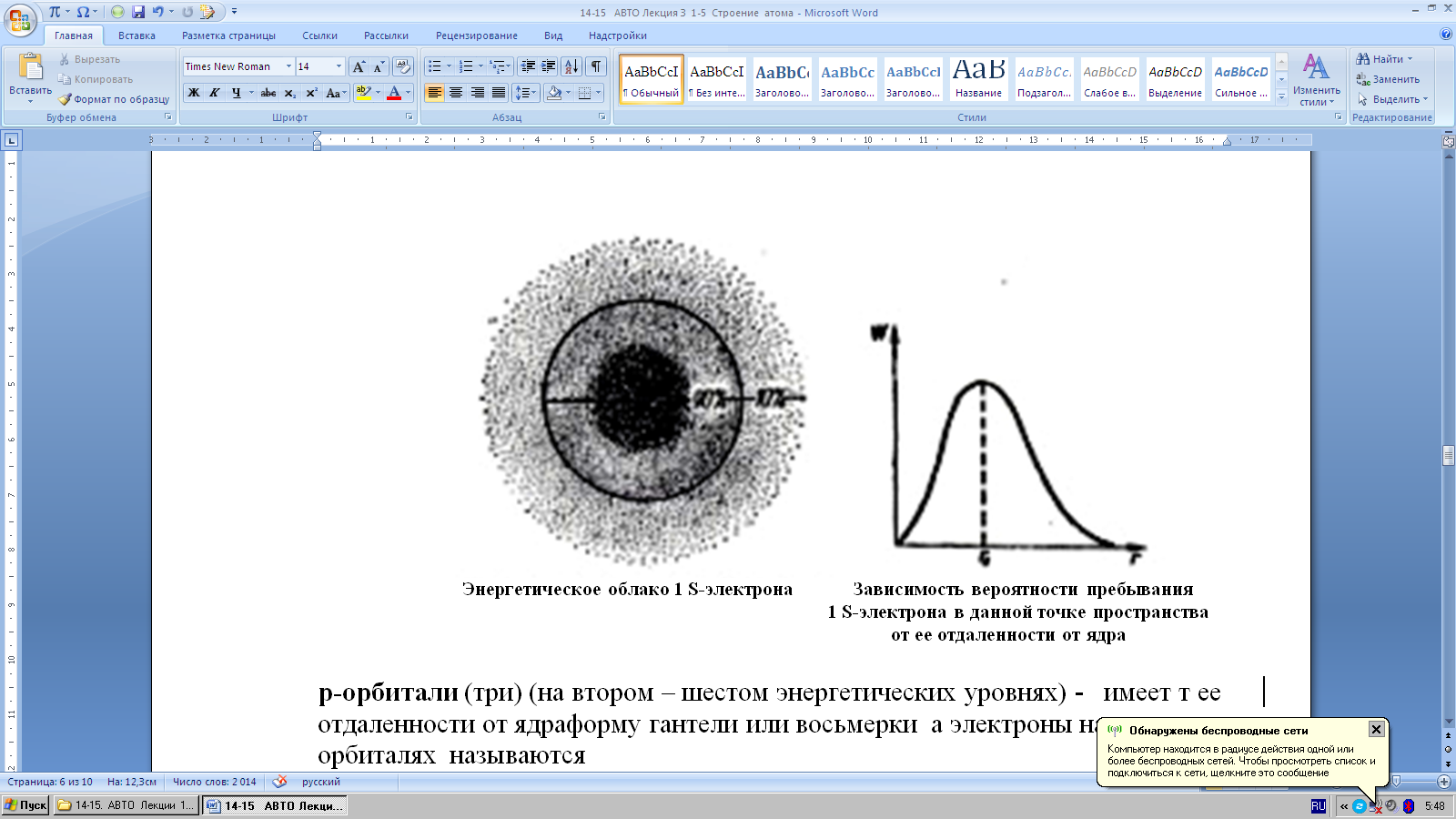
S-орбиталь ( по одной на каждом из семи энергетических уровней) - имеют сферическую (шарообразную) форму, а электроны, занимающие эту орбиталь называются S-электронами.
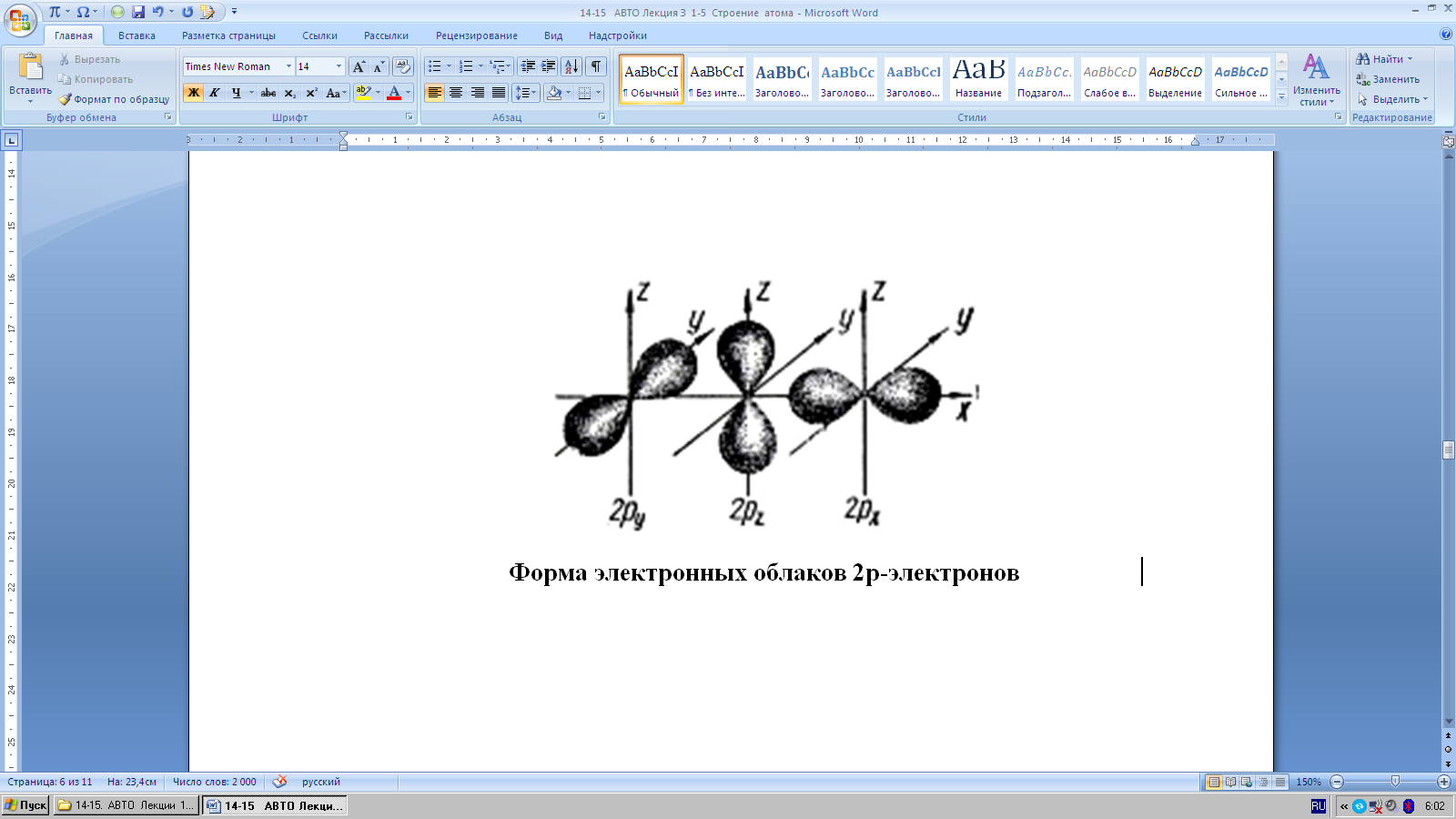
р-орбитали (три) (на втором – шестом энергетических уровнях) - имеет т ее отдаленности от ядраформу гантели или восьмерки а электроны на р-орбиталяхназываются
|
|
|
р-электронами.
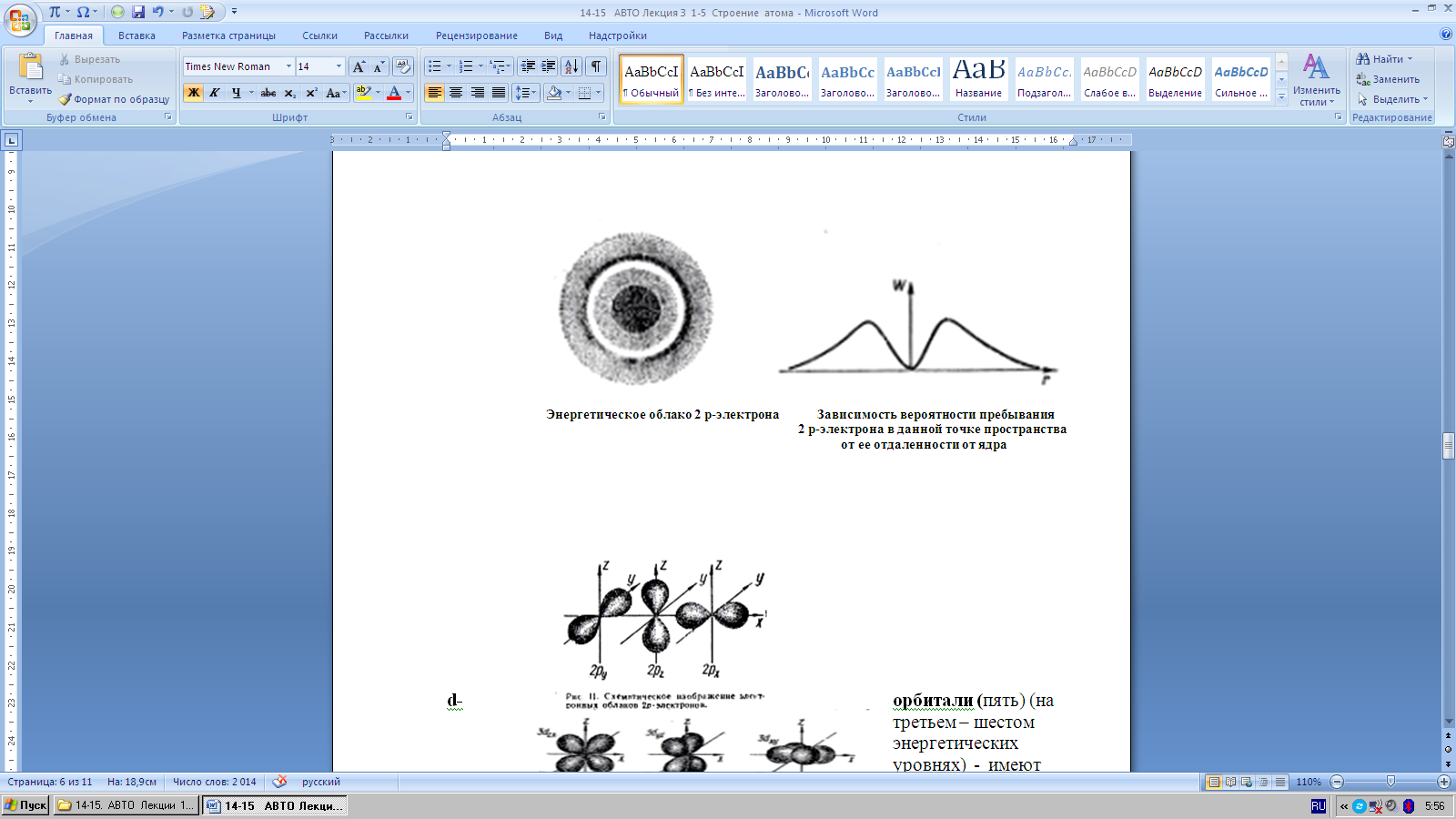
d-орбитали ( пять) (на третьем – шестом энергетических уровнях) - имеют форму гантели, а электроны, занимающие эти орбитали называются
 2015-10-16
2015-10-16 553
553








