| Химическая формула | Наименование | Техническое обозначение | Температура плавления, °C | Температура кипения, °C | Относительная молекулярная масса |
| CFH3 | фторметан | R41 | -141,8 | -79,64 | 34,033 |
| CF2H2 | дифторметан | R32 | -136 | -51,7 | 52,024 |
| CF3H | трифторметан | R23 | -155,15 | -82,2 | 70,014 |
| CF4 | тетрафторметан | R14 | -183,6 | -128,0 | 88,005 |
| CFClH2 | фторхлорметан | R31 | -- | -9 | 68,478 |
| CF2ClH | дифторхлорметан | R22 | -157,4 | -40,85 | 86,468 |
| CF3Cl | трифторхлорметан | R13 | -181 | -81,5 | 104,459 |
| CFCl2H | фтордихлорметан | R21 | -127 | 8,7 | 102,923 |
| CF2Cl2 | дифтордихлорметан | R12 | -155,95 | -29,74 | 120,913 |
| CFCl3 | фтортрихлорметан | R11 | -110,45 | 23,65 | 137,368 |
| CF3Br | трифторбромметан | R13B1 | -174,7 | -57,77 | 148,910 |
| CF2Br2 | дифтордибромметан | R12B2 | -141 | 24,2 | 209,816 |
| CF2ClBr | дифторхлорбромметан | R12B1 | -159,5 | -3,83 | 165,364 |
| CF2BrH | дифторбромметан | R22B1 | -- | -15,7 | 130,920 |
| CFCl2Br | фтордихлорбромметан | R11B1 | -- | 51,9 | 181,819 |
Но, многолетние исследования атмосферы и стратосферы показали, что бром и хлорсодержащие фреоны, достаточно видимым образом разрушают озоновый слой. Надо отметить, что атмосферный озон играет важную роль для всего живого на планете. Образуя озоновый слой в стратосфере, он защищает растения и животных от жёсткого ультрафиолетового излучения. Поэтому проблема образования озоновых дыр имеет особое значение. При этом положительную роль играет Стратосферный озон (на высоте около 15-35 км), а тропосферный озон (на высоте (менее 15 км) является загрязнителем, который может угрожать здоровью людей и животных, а также повреждать растения.
|
|
|
В данном случае озо́новая дыра́ — локальное падение концентрации озона в озоновом слое Земли. По общепринятой в научной среде теории, во второй половине XX века всё возрастающее воздействие антропогенного фактора в виде выделения хлор- и бромсодержащих фреонов привело к значительному утончению озонового слоя, см. например доклад Всемирной метеорологической организации
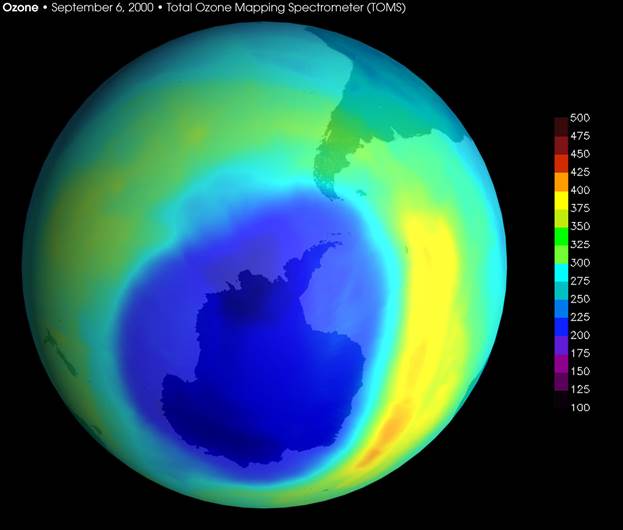
Изображение антарктической озоновой дыры, сентябрь 2000.
Пути гибели Озона
Кроме реакций, входящих в механизм Чепмена, имеется целый ряд других реакций, приводящих к гибели озона. Их все объединяют в несколько семейств, главными из которых является азотное, кислородное (из механизма Чепмена), водородное и галогеновое. Эти реакции представляют собой каталитические циклы, поэтому их также называют соответствующими циклами.
Азотный цикл (NOx):
N2O + O(1D) → NO + NO,
О3 + NO → NO2 + О2,
NO2 + О → NO + О2.
Водородный цикл (HOx):
Н2O + O → OH + OH,
ОН + О3 → НО2 + О2,
НО2 + О3 → ОН + 2О2.
Хлорный цикл (ClOx):
CFCl3 + h ν → CFCl2 + Cl,
Cl + O3 → ClO + O2,
ClO + O → Cl + O2.
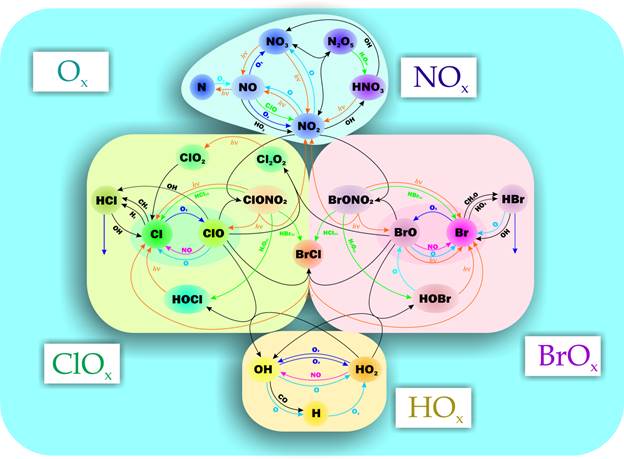
Стратосферная химия озона
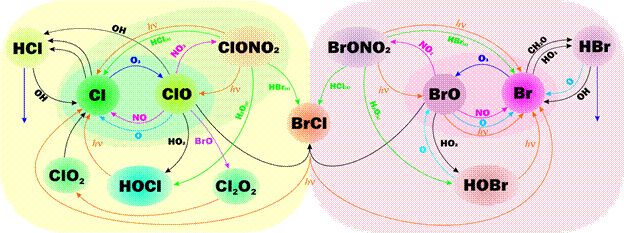
Схема реакции галогенов в стратосфере включающая реакции галогенов с озоном
К уменьшению концентрации озона в атмосфере ведёт совокупность факторов, главными из которых является гибель молекул озона в реакциях с различными веществами антропогенного и природного происхождения, отсутствие солнечного излучения в течение полярной зимы, особо устойчивый полярный вихрь, который препятствует проникновению озона из приполярных широт, и образование полярных стратосферных облаков (ПСО), поверхность частиц которого катализируют реакции распада озона. Эти факторы особенно характерны для Антарктики, в Арктике полярный вихрь намного слабее ввиду отсутствия континентальной поверхности, температура выше на несколько градусов, чем в Антарктике, а ПСО менее распространены, к тому же имеют тенденцию к распаду в начале осени. Будучи химически активными, молекулы озона могут реагировать со многими неорганическими и органическими соединениями. Главными веществами, вносящими вклад в разрушение молекул озона, являются простые вещества (водород, атомы кислорода, хлора, брома), неорганические (хлороводород, моноксид азота) и органические соединения (метан, фторхлор- и фторбромфреоны, которые выделяют атомы хлора и брома). В отличие, например от гидрофторфреонов, которые распадаются до атомов фтора, которые, в свою очередь, быстро реагируют с водой образуя стабильный фтороводород. Таким образом, фтор не участвует в реакциях распада озона. Йод также не разрушает стратосферный озон, так как иодсодержащие органические вещества почти полностью расходуются ещё в тропосфере. Основные реакции, вносящие вклад в разрушение озона приведены в статье про озоновый слой.
|
|
|
В соответствии со степенью воздействия на озоновый слой фреоны (хладоны) делят на следующие группы:
| Группа | Класс соединений | Фреоны (хладоны) | Воздействие на озоновый слой |
| A | Хлорфторуглероды(CFC) | R11, R12, R13, R111, R112, R113, R114, R115 | Вызывают истощение озонового слоя |
| Бромфторуглероды | R12B1, R12B2, R113B2, R13B2, R13B1, R21B1, R22B1, R114B2 | ||
| B | Хлорфторуглеводороды (HCFC) | R21, R22, R31, R121, R122, R123, R124, R131, R132, R133, R141, R142, R151, R221, R222, R223, R224, R225, R231, R232, R233 | Вызывают слабое истощение озонового слоя |
| C | Фторуглеводороды (HFC) | R23, R32, R41, R125, R134, R143, R152, R161,R227, R236, R245, R254 | Озонобезопасные фреоны (хладоны) |
| Фторуглероды (перфторуглеводороды) (CF) | R14, R116, R218, RC318 |
Что надо знать при создании современного научно-технического проекта
 2015-10-16
2015-10-16 1477
1477








