
В таблицы 17 и на рисунках 17 и18 приведены наиболее распространенные типы гибридизации атомных орбиталей.
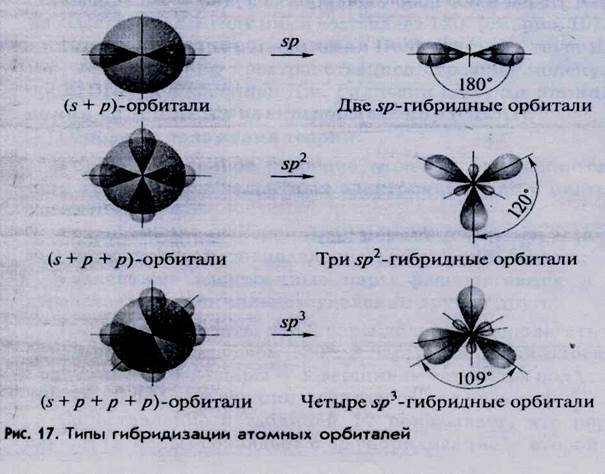
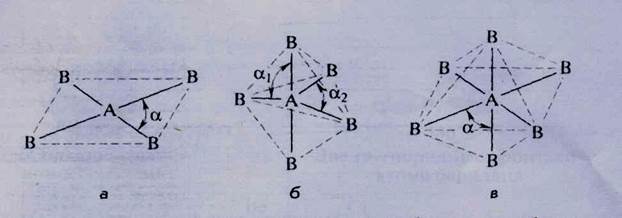
Рис. 18. Геометрическая модель структуры с гибридными орбиталями:
а — 5р 2 с/-гибридизация (плоский квадрат); б — 5р 3 сУ-гибридизация
(тригональная билирамида); в — 5р 3 сР-гибридизация (октаэдр)
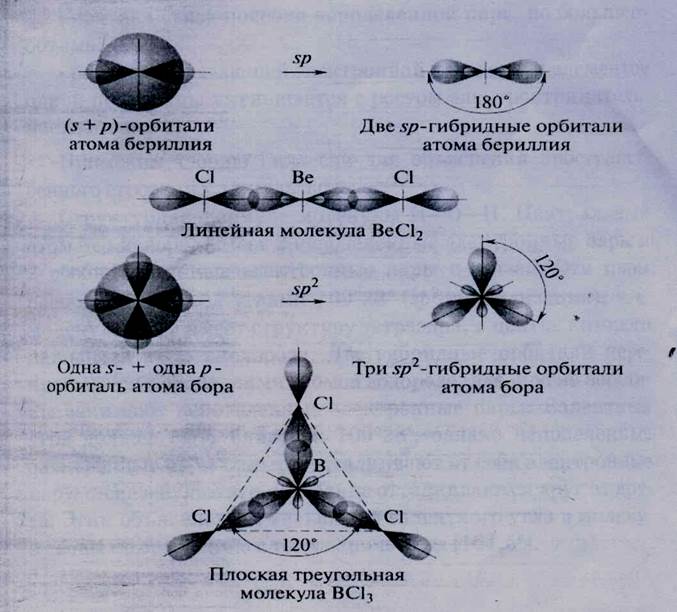
Гибридные орбитали располагаются в пространстве на максимальном удалении друг от друга. Например, в молекуле ВеСI2 («р-гибридизация орбиталей атома бериллия), образуются две гибридные орбитали, располагающиеся под углом 180°. Максимум электронной плотности располагается в большей половине гантели. Поэтому именно в этой области происходит перекрывание с орбиталями атомов хлора. Соединив отрезками ядра атомов бериллия и хлора, получаем валентный угол, равный 180° (рис. 19). В молекуле BCI3 (sp 2 - ги б ридизация орбиталей атома бора) оси гибридных орбиталей лежат в одной плоскости, угол между ними составляет 120° (см. рис. 19).
· Помимо теории гибридизации Полинга существует и другая, объясняющая пространственное строение молекул теория. Это предложенная Дж. Гиллеспи теория отталкивания валентных электронных пар (ОВЭП).
|
|
|
· Основные положения теории:
· пространственное строение молекул определяется общим количеством валентных электронных пар у центрального атома;
· валентными электронными парами являются электронные пары 0-связей и неподеленные электронные пары;
· валентные электронные пары располагаются в пространстве на максимальном удалении друг от друга.
Нетрудно показать, что 2 пары должны располагаться на одной прямой иод углом 180°; 3 пары — в одной плоскости под углами 120°; 4 пары — к вершинам тетраэдра под углами 109°28'; 6 пар — к вершинам октаэдра под углами 90°.
Сопоставление с таблицей 17 показывает, что первый случай (2 пары) совпадает с яр гибридизацией, второй случай (3 пары) с а/?2-гибридизацией, третий случай (4 пары) с $р3~гибридизацией и четвертый случай (6 пар) — с s гибридизацией. Таким образом, теория Гиллеспи приводит к тем же выводам, что и теория гибридизации Полинга.
Однако Полинг полагал, что в гибридизации могут принимать участие только обобществленные электронные пары. Гиллеспи же считал, что на пространственную структуру молекул влияют и неподеленные электронные пары. Суммируя экспериментальные факты, Гиллеспи сформулировал несколько правил, позволяющих предсказать геометрию молекулы:
- геометрия молекулы определяется отталкиванием электронных пар в валентной оболочке центрального атома;
- наибольшее место в пространстве занимает неподелен- ная пара;
- кратная связь подобна неподеленной паре, но большего объема;
- размер связывающей электронной пары среди элементов одной подгруппы уменьшается с ростом электроотрицательности атома.
Применим теорию Гиллеспи для объяснения пространственного строения молекулы воды.
|
|
|
Структурная формула молекулы Н—О—Н. Центральный атом — кислород имеет 2 неподеленные электронные пары и 2 обобществленные электронные пары a-связей. Эти пары располагаются под углами 109°28' (8р3-гибридизация), т.е. молекула воды имеет структуру тетраэдра, в центре которого находится атом кислорода. Две гибридные орбитали перекрываются с орбиталями атомов водорода, две другие вершины занимают неподеленные электронные пары. Валентный угол должен быть близок к 109°28', однако неподеленные электронные пары сильнее отталкивают от себя электронные пары о-связей, чем эти последние отталкиваются друг от друга. Этим объясняется уменьшение валентного угла в молекуле воды по сравнению с тетраэдрическим (104,5°).
 2015-10-16
2015-10-16 7448
7448







