Литературный обзор
Проблемы химии молекулярных металлохелатов (ММХ) в последние годы привлекают пристальное внимание исследователей. Особое положение занимают металлохелаты, имеющие координационный узел MN4. Они являются не только хорошими моделями для изучения проблемы азокоординации в химии комплексных соединений, но и обладают целым рядом практически полезных свойств. Представляют интерес в качестве высокоактивных катализаторов, фото- и термочувствительных элементов, молекулярных магнетиков.
Исследование подобных координационных соединений относится к числу фундаментальных проблем, изучаемых на стыке химических дисциплин, так как позволяет не только устанавливать влияние лигандного окружения на структуру координационного узла и физико-химические свойства металлокомплексов, а также оценивать реакционную способность и формы существования органических молекул, входящих в состав металлокомплексных соединений. [Прогресс в химии формазанов]
Металлохелатами называются комплексные соединения, отличительными признаками которых являются наличие одного или нескольких металлоциклов и повышенная устойчивость по сравнению с нехелатными аналогами. Такие комплексы образуются лигандами, содержащими два и более донорных центров, которые по стерическим возможностям способны координировать один ион металла.
|
|
|
Координационные способности гетарилформазанов
Среди большого количества органических лигандов важное место занимают азотсодержащие производные, в частности формазаны (азогидразоны), особенно гетероциклические, которые являются типичными хелатирующими лигандами.
Молекула формазана имеет широкую возможность варьирования тонкой структуры (посредством управления природой донорных атомов, таутомерно-изомерного равновесия, введением гетероциклических фрагментов и других заместителей), что позволяет вести целенаправленный синтез металлокомплексов заданного состава и строения.[ Строение координ.соедин.переходн.металлов с полидент.формазанами ]
Ученые доказали, что 1(5)-арил-5(1)-гетарил формазаны, имеющие таутомерно-подвижный водород, очень легко образуют комплексные соединения с металлами. Для синтеза внутрикомплексных соединений (ВКС) 1(5)-арил-5(1)-гетарил- и 1, 5-дигетарилформазанов в последнее время широко начали использовать ацетаты металлов, что дает возможность в ряде случаев избежать образования моллекулярных аддуктов типа М(L-H)2·nMX2. которым сопровождается комплесообразование медних металлохелатов. Аддуктообразование значительно усложняет выделение чистых Cu(L-H)2 комплексов и требует многократной кристаллизации Cu(L-H)2·nCuCl2 из водного пиридина. Варьируя природу МХn и условия синтеза, можно получить гетарилформазанаты различного типа (молекулярные или хелатные).
|
|
|
Строение молекулярных комплексов гетарилформазанов исследовалось главным образом спектральными методами и методами дипольных моментов, а структура металлохелатов, кроме того, методами магнетохимии. Составы МХnL и MXn2L еще не указывают на природу образующихся комплексов, так как на ряду с продуктами присоединения MXn к формазанам (1.1) тот же элементный состав могут иметь ионогенные соединения (1.2) типа солей или цианинов (1.3).
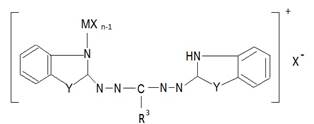
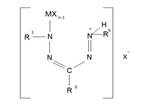
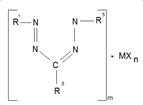
1.1 1.2 1.3
(M – Ti, Sn, Zn; m-1,2; n-2,4; X- Cl, Y – O, S)
Выбор между указанными структурами в пользу комплекса 1.1 для МCl4 и цианина 1.3 для ZnCl2 был сделан на основе данных Ик-, УФ-спектров и величин дипольных моментов. В ИК-спектрах MCl4·L и MCl4·2L отсутствует частота поглощения иммониевой группировки +NH-, которую следовало ожидать для ионной структуры 1.2.
Гетарилформазаны являются амбидентными системами, содержащими несколько потенциально возможных донорных центров: атомы азота формазанного и азольного циклов, О и S- атомы бензтиазольного и бензоксазольного колец, соответственно. В этой связи при изучении молекулярных комплексов 1.1 решался вопрос о месте локализации координационной связи в гетарилформазанной системе(конкурентная координация). Данные ИК-спектров в согласии с результатами квантово-химических расчетов позволили заключить, что МХn координирован по N3-атому азольного фрагмента, а в случае комплексов состава 2ТiCl4·L и по N2(4)-атому формазанного цикла.
(Бузыкин, Химия формазанов)
Наличие в формазанах NH2-группы позволяет хелатировать не только ионы металлов переходного ряда, подобно Ni2+ и Mn2 +, а также Pd2+ и Pt2+, но и тяжелые, а соответственно и «мягкие» металлы (1.4). Например, впервые получены полимерные комплексы Ir3+ и Au3+. В ИК спектре такого полимерного основания Шиффа наблюдаются две полосы v (NH) при 3405 и 3250 см-1. После комплексообразования остается одна полоса в районе 3325—3380 см-1 в зависимости от природы металла. Полоса V (C=N) при 1630 см-1 смещается до ж 1600 см-1. Эти данные позволяют приписать комплексам следующую структуру с координационным узлом MN4.
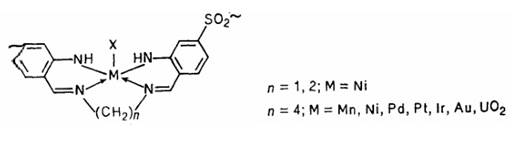
1.4
Термическая стабильность комплексов практически не отличается от стабильности кислородных аналогов, однако отмечается более высокая термическая стабильность комплекса Au3+.
 2015-10-13
2015-10-13 355
355







