Навеску алюминия массой 13,7 г полностью сожгли в хлоре, а из образовавшейся соли приготовили 250 мл раствора. Пробу в 50 мл этого раствора слили с 68,4 мл 10,4 %‑ного раствора аммиака (плотность раствора 0,956 г/мл). Определите массу (в граммах) выпавшего осадка.
Элементы ответа.
1) Составлены уравнения реакций:
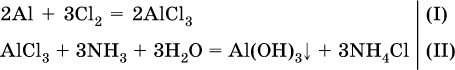
2) Определены количества AlCl3 в реакциях (I) и (II):
в реакции (I)
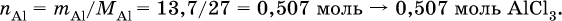
в реакции (II) взята 1/5 часть AlCl3, т. к.
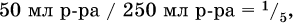
отсюда
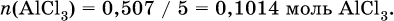
3) Определено количество NH3 в растворе для реакции (II):
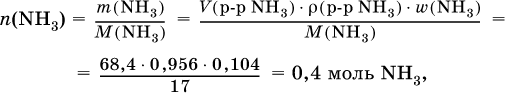
следовательно, NH3 – в избытке, и расчет далее ведется по AlCl3.
4) Определена масса Al(ОН)3 по уравнению (II): 0,1014 моль AlCl3 – 0,1014 моль Al(ОН)3,
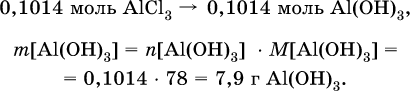
 2015-10-13
2015-10-13 426
426








