В термодинамике движение тела как целого не рассматривается и речь идет о перемещении частей макроскопического тела относительно друг друга. При совершении работы меняется объем тела, а его скорость остается раной нулю. Но скорости молекул тела меняются! Поэтому меняется температура тела. Причина в том, что при столкновении с движущимся поршнем (сжатие газа) кинетическая энергия молекул изменяется - поршень отдает часть своей механической энергии. При столкновении с удаляющимся поршнем (расширение) скорости молекул уменьшаются, газ охлаждается. При совершении работы в термодинамике меняется состояние макроскопических тел: их объем и температура.
Вычисление работы. Вычислим работу в зависимости от изменения объема на примере газа в цилиндре под поршнем (рис.13.1).
Проще всего вначале вычислить не работу силы 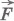 , действующей на газ со стороны внешнего тела (поршня), а работу, которую совершает сила давления газа, действуя на поршень с силой
, действующей на газ со стороны внешнего тела (поршня), а работу, которую совершает сила давления газа, действуя на поршень с силой 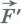 . Согласно третьему закону Ньютона
. Согласно третьему закону Ньютона  . Модуль силы, действующей со стороны газа на поршень, равен
. Модуль силы, действующей со стороны газа на поршень, равен 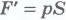 , где p - давление газа, а S - площадь поверхности поршня. Пусть газ расширяется изобарно и поршень смещается в направлении силы
, где p - давление газа, а S - площадь поверхности поршня. Пусть газ расширяется изобарно и поршень смещается в направлении силы 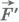 на малое расстояние
на малое расстояние 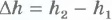 . Так как давление газа постоянно, то работа газа равна:
. Так как давление газа постоянно, то работа газа равна:
|
|
|
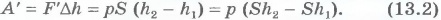
Эту работу можно выразить через изменение объема газа. Начальный его объем V1=Sh1, а конечный V2=Sh2. Поэтому
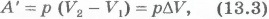
где 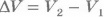 - изменение объема газа.
- изменение объема газа.
При расширении газ совершает положительную работу, так как направление силы и направление перемещения поршня совпадают.
Если газ сжимается, то формула (13.3) для работы газа остается справедливой. Но теперь  , и поэтому
, и поэтому  (рис.13.2).
(рис.13.2).
Работа A, совершаемая внешними телами над газом, отличается от работы самого газа A ´ только знаком:  , так как сила
, так как сила 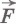 , действующая на газ, направлена против силы
, действующая на газ, направлена против силы  а перемещение поршня остается тем же самым. Поэтому работа внешних сил, действующих на газ, равна:
а перемещение поршня остается тем же самым. Поэтому работа внешних сил, действующих на газ, равна:
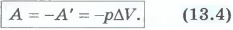
При сжатии газа, когда 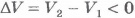 , работа внешней силы оказывается положительной. Так и должно быть: при сжатии газа направления силы и перемещения точки ее приложения совпадают.
, работа внешней силы оказывается положительной. Так и должно быть: при сжатии газа направления силы и перемещения точки ее приложения совпадают.
Если давление не поддерживать постоянным, то при расширении газ теряет энергию и передает ее окружающим телам: поднимающемуся поршню, воздуху и т. д. Газ при этом охлаждается. При сжатии газа, наоборот, внешние тела передают ему энергию и газ нагревается.
Геометрическое истолкование работы. Работе A´ газа для случая постоянного давления можно дать простое геометрическое истолкование.
Построим график зависимости давления газа от занимаемого им объема (рис.13.3). Здесь площадь прямоугольника abdc, ограниченная графиком p1 =const, осью V и отрезками ab и cd, равными давлению газа, численно равна работе (13.3):
|
|
|

В общем случае давление газа не остается неизменным. Например, при изотермическом процессе оно убывает обратно пропорционально объему (рис.13.4). В этом случае для вычисления работы нужно разделить общее изменение объема на малые части и вычислить элементарные (малые) работы, а потом все их сложить. Работа газа по-прежнему численно равна площади фигуры, ограниченной графиком зависимости p от V, осью V и отрезками ab и cd, равными давлениям p1, p2 в начальном и конечном состояниях газа.
Вводится понятие «работа газа», рассматриваются особенности работы газа при изохорном, изобарном, изотермическом и адиабатном процессах.
Внутренняя энергия тела может изменяться, если действующие на него внешние силы совершают работу (положительную или отрицательную). Например, если газ подвергается сжатию в цилиндре под поршнем, то внешние силы совершают над газом некоторую положительную работу A'. В то же время силы давления, действующие со стороны газа на поршень, совершают работу A = – A'. Если объем газа изменился на малую величину Δ V, то газ совершает работу pS Δ x = p Δ V, где p – давление газа, S – площадь поршня, Δ x – его перемещение.
При расширении работа, совершаемая газом, положительна, при сжатии – отрицательна. В общем случае при переходе из некоторого начального состояния (1) в конечное состояние (2) работа газа выражается формулой:

|
или в пределе при Δ Vi → 0:

|
В изохорном процессе (V = const) газ работы не совершает, A = 0.
В изобарном процессе (p = const) работа, совершаемая газом, выражается соотношением:
| A = p (V 2 – V 1) = p Δ V. |
В изотермическом процессе температура газа не изменяется, следовательно, не изменяется и внутренняя энергия газа, Δ U = 0.
Первый закон термодинамики для изотермического процесса выражается соотношением Q = A.
Количество теплоты Q, полученной газом в процессе изотермического расширения, превращается в работу над внешними телами. При изотермическом сжатии работа внешних сил, произведенная над газом, превращается в тепло, которое передается окружающим телам.
Наряду с изохорным, изобарным и изотермическим процессами в термодинамике часто рассматриваются процессы, протекающие в отсутствие теплообмена с окружающими телами. Сосуды с теплонепроницаемыми стенками называются адиабатическими оболочками, а процессы расширения или сжатия газа в таких сосудах называются адиабатическими.
Работа газа в адиабатическом процессе выражается через температуры T 1 и T 2 начального и конечного состояний:
| A = CV (T 2 – T 1). |
 2018-01-08
2018-01-08 3685
3685