а) аддитивность – коагулирующее действие электролитов в смеси равно сумме коагулирующих действий каждого электролита. Такое явление наблюдается редко, когда ионы–коагулянты имеют одинаковый заряд и близки по степени гидратации;
б) антагонизм – коагулирующее действие ионов в смеси становится меньше, чем их действие в отдельности;
в) синергизм – коагулирующее действие ионов в смеси повышается.
Стабилизация золей по отношению к электролитам путем добавления незначительного количества высокомолекулярных соединений (ВМС) получила название коллоидной защиты, а вещества, вызывающие ее – защитные. Защитными свойствами обладают высокомолекулярные соединения, как например, белковые вещества (желатин, альбумины, казеин), полисахариды (крахмал, декстрин), некоторые коллоидные ПАВ (мыла, сапонины).
Процесс перехода осадка во взвешенное состояние под влиянием внешних факторов получил название пептизации (процесс, обратный коагуляции – декоагуляция). Вещества, способствующие переходу коагулянта в золь, называют пептизаторами. Обычно пептизаторами являются электролиты, однако роль пептизатора может выполнить и растворитель.
|
|
|
Изучение процессов коагуляции представляет большой интерес для биологов, медиков и фармацевтов. Явление коагуляции играет существенную роль в живом организме, так как коллоидные растворы клеток и биологических жидкостей находится в соприкосновении с электролитами. Так, физиологический раствор хлорида натрия нельзя заменить изотоническим раствором хлорида магния, поскольку в этой соли имеется двухзарядный ион магния, обладающий высоким коагулирующим действием.
Коагуляция коллоидных растворов фосфата кальция и холестерина в крови приводит к образованию и отложению осадков на внутренней поверхности кровеносных сосудов. Свертывание крови, слипание эритроцитов также представляют собой процессы, аналогичные коагуляции. Решение многих проблем в медицине (например, протезирование кровеносных сосудов, клапанов сердца и т.д.) связано с проблемой свертывания крови. Так в хирургии во время операций в кровь вводят антикоагулянты
(гепарин), а после операций – для повышения коагуляции – протамин –сульфат. С явлением коагуляции эритроцитов вследствие уменьшения их дзета–потенциала врачи постоянно имеют дело в клинических лабораториях (метод
определения СОЭ – скорости оседания эритроцитов). Это явление объясняется тем, что при патологии в крови увеличивается содержание некоторых видов белков, место ионов электролитов на поверхности эритроцитов занимают белки, заряд которых ниже, чем у суммы замещенных ими ионов. Заряд эритроцитов понижается, они быстрее объединяются и оседают. При изготовлении лекарственных препаратов, представляющих собой коллоидные растворы, необходимо защищать их от возможной коагуляции,
|
|
|
например, коллоидные препараты окиси серебра – колларгол и протаргол. В гигиене и санитарии применяют коагуляцию для очистки питьевых и сточных вод. Используя электролиты в медико–санитарной практике необходимо всегда
учитывать возможность коагуляции в биологических средах. Так при введении различных лекарственных препаратов в организм (в виде инъекций) следует предварительно убедиться в том, что эти вещества не являются синергистами,
чтобы избежать возможной коагуляции. С другой стороны, при очистке промышленных вод вредным может оказаться антагонизм вводимых электролитов, препятствующий разрушению коллоидных загрязнений.
18. Лигандно-обменные равновесия. Комплексные соединения – соединения, молекулы которых состоят из центрального атома(иона), непосредственно связанного с определенным числом других молекул.
Основные положения координационной теории:
1. Различают внутреннюю и внешнюю сферы.
2. Во внутренней сфере центральное место занимает комплексообразователь – чаще катион металла, реже – анион или нейтральный атом.
3. Комплексообразователь окружен лигандами – противоположно заряженными ионами или нейтральными частицами.
4. Число свободных орбиталей, предоставляемых комплексообразователем для неподеленных электронных пар лигандов, называется координационным числом комплексообразователя.
5. Комплексообразователь и лиганды образуют внутреннюю (координационную) сферу. В формулах она заключается в квадратные скобки.
6. Заряд внутренней сферы = сумме зарядов всех частиц внутренней сферы.
7.Ионы, не разместившиеся во внутренней сфере, образуют внешнюю сферу. Суммарный заряд ионов внешней сферы нейтрализует заряд внутренней сферы.
ЭДТА (этилендиаминтетрауксусной кислоты)
HOOC – CH2 CH2 – COOH
N – CH2 – CH2 – N
HOOC – CH2 CH2 – COOH
ТрилонБ
Na+-OOC – CH2CH2 – COOH
N – CH2 – CH2 – N
Na+-OOC – CH2CH2– COOH
Используетсядля растворения желчных и почечных камней; при отравлении тяжелыми металлами.
19.Тетацин
O
Na+-OOC – CH2CH2 – C – O
N – CH2 – CH2 – N Ca
Na+-OOC – CH2CH2– C – O
o
Применяется при отравлении тяжелыми металлами.
[CaL]2- + Pb2+Ca2+ + [PbL]2-
Внутрикомплексные хелатные соединения играют огромную роль в живой природе.Железо-порфириновый комплекс входит в состав гемоглобина, цитохромов. В легких молекула кислорода присоединяется к железу гема, а в тканях высвобождается и расходуется на процессы жизнедеятельности. При попадании в организм окислителей ион железа в гемоглобине окисляется до трехзарядного, не способного переносить кислород. Комплекс порфирина с магнием является основной молекулой хлорофилла, с кобальтом3+ - витамина В12.
Металло-лигандный гомеостаз – относительное динамическое постоянство концентраций катионов биометаллов, биолигандов и образуемых ими комплексов, обусловливающее устойчивость физиологических функций. Нарушение возникает при:
1. Избытке или дефиците катионов биометаллов.
2. Поступлении в организм катионов токсичных металлов.
3. Поступлении или образовании посторонних лигандов.
Пример: При поступлении в кровь угарного газа образуется комплекс (карбоксигемоглобин) в 240 раз более устойчивый по сравнении с оксигемоглобином.
20.ВМС –вещества, имеющие молекулярную массу от нескольких тысяч до нескольких миллионов.
Вязкость – внутренне трение – это мера сопротивления среды движению. Вязкость крови изучают при патологиях. В норме = 0,05 Пуаз(воды = 0,01 Пуаз, глицерин = 8 Пуаз). Вискозиметрия – раздел физики, посвященный изучению методов измерения вязкости.
F = η*S* 
 – градиент скорости
– градиент скорости
S – площадь контакта слоев
η – коэффициент вязкости η = η0*(1+2.5  ) η0 – вязкость растворителя,
) η0 – вязкость растворителя,  - объемная С р-ля.
- объемная С р-ля.
F – сила вязкого сопротивления
|
|
|
Осмотическое давление растворов ВМС подчиняется уравнению Галлера:
Pocм = 
C –концентрация ВМС, М – его масса;
 – коэффициент, учитывающий гибкость и форму ВМС.
– коэффициент, учитывающий гибкость и форму ВМС.
При малых С переходит в уравнение Вант- Гоффа. В сложных биологических системах, содержащих электролиты, неэлектролиты и белки, каждый из компонентов вносит вклад в суммарное осмотическое давление. Часть давления, обусловленная наличием белков, называется онкотическим давлением (крови = 0.04 атм). Онкотическое давление способствует перемещению безбелковой части плазмы крови из капилляров в ткани.
Равновесие Доннана – состояние, возникающее в системе растворов, разделенных мембраной, непроницаемой хотя бы для одного вида ионов, присутствующих в системе. Приводит к повышению Росм внутри клетки и уменьшении снаружи. Внутриклеточный раствор становится гипертоническим по сравнению с внеклеточным, поэтому она набухает. На мембране возникает мембранный потенциал.
Гели – связнодисперсная система, образованная молекулами полимеров в форме пространственных сеток, ячейки которых заполнены растворителем. Различают хрупкие (построенные из жестких частиц) и эластичные (растворы ВМС) гели; естественные и искусственные.
Гелям свойственно: адсорбция; диффузия; электропроводность; Тиксотропия – явление изотермического обратимого перехода геля в золь и обратно под влиянием механического воздействия; Синерезис – процесс самопроизвольного расслоения геля на жидкость и твердую фазу. Синерезис необратим. Синерезис наблюдается в процессе старения человеческого организма. С возрастом эластичность тканей уменьшается и происходит их дегидратация. Явление синерезиса используется для определения скорости оседания эритроцитов(СОЭ). В норме 10-12 мм/час; осаждение. Реакции с выделением CA3(PO4)2и Ag2Cr2O7 имеют периодический характер.
Отложение солей происходит слоями в виде концентрических колец.
21.спирты
|
|
|
Спирты -это производные УВ,в молекулах которых один или несколько атомов водорода замещены гидроксильными группами.
По строению УВ радикала: 1. Насыщенные, 2. ненасыщенные, 3. циклические, 4. ароматические.
По числу гидроксильных групп: 1. одно-, 2. двух-, 3. трёх-, 4. многоатомные.
По строению УВ скелета и положению в цепи ОН-группы: 1.первичный, 2.вторичный, 3.третичный.
Спирты почти не проявляют кислотных св-в. Они не реагируют со щелочами,но при действии металлическогоNa образуют алкоголяты: 2R-OH+2Na®2R-ONa+H2
Реакции нуклеофильного замещения(Sn): R-Cd+->OHd-+: Y- ® R-C-Y+: OH-
Реакции элиминирования (внутримолекулярная дегидратация) (Е):
R-CH-CH2OH ®H2SO4® R-CH=CH2+H2O
Окисление спиртов: первичных(альдегиды): R-C-OH ®[O] R-C-(OH)2®R-C=O+H2O.
вторичных(кетоны): R1-C-OH-R2 ®[O] R1-C-(OH)2-R2 ® R1-C=O-R2+H2O
Альдегиды. Строение
Альдегиды - производные УВ,содержащие карбонильную группу >Сd+=Оd-,называемую так же оксогруппой или карбонилом.
Электронное строение:sp2-гибридизованный атом углерода образует 3d-связи и p-св. с кислородом за счет негибридизованной р-орбитали. p-св. сильно поляризованна и электронная пара смещена к более ЭО атому кислорода=> на нём возникает - заряд(-d),а на углероде + заряд(+d).
Реакции нуклеофильного присоединения(АN): R1-Cd+=Od-+Ed+-Yd- ® R1-(Y-C-O-) +E+ ® R-(Y-CH-OE)
Образование полуацеталей и ацеталей: R1®Cd+H=Od-+R2®CHd+2®Od-Hd+ ® R1-CH-O- -(O-CH2-R2) (полуацеталь) +H+ ® R1-CH-OH-(O-CH2-R2)+Hd+®Od-CH2d+R3 ® R1-CH-(O-CH2-R2)-(O-CH2-R3) (ацеталь) +H2O
Восстановление: R®Cd+H=Od-(альдегид) ®[H] R-CH2-OH (перв.одноат.спирт)
Окисление: R®Cd+H=Od-(альдег.)+ Ag2O ® R-C-(OH)=O (карб.к-та)+ 2Ag¯
Присоединение-отщепление: R1®Cd+=Od-(-R2) (этиламин) +H-Nd-H-C2H5 ®H+ R2-(R1)-C=N-C2H5 (имин) +H2O
Альдегиды.таутомерия
Альдегиды- производные УВ,содержащие карбонильную группу >С=О,называемую так же оксогруппой или карбонилом.
Кето-енольная таутомерия: ( R-)H®C(H)®Cd+H=Od-(кето-форма) « R-CH=CH-OH (енольная форма); ( R1-)Hd+®C(H)®Cd+(R2)=Od- « R1-СH=C(-R2)-OH
P-ияальдольной конденсации: R1-СH2®Cd+H=Od- +H®C(-R2)-H-CH=O ® R1-СH2®CH(-OH)-C(-R2)-H-CH=O (адоль) ® R1-СH2-CH=C(-R2)-CH=O (кротон)
Галоформная р-ия: R®(H®)-C(H)®Cd+H=Od-+2 Cld+®Cld- ® R-(Cl)-C(®Cl) ~ CH=O+2HCl ®+NaOH R-C-Cl2-H (галоформ) + NaO-CH=O (формиат Na) +2HCl
Кетоны
Кетоны- производные УВ,содержащие карбонильную группу >С=О,называемую так же оксогруппой или карбонилом.
Электронное строение:sp2-гибридизованный атом углерода образует 3d-связи и p-св. с кислородом за счет негибридизованной р-орбитали. p-св. сильно поляризованна и электронная пара смещена к более ЭО атому кислорода=> на нём возникает - заряд(-d),а на углероде + заряд(+d).
Р-ии нуклеофильного присоединения(АN): R1®Cd+-R2(=Od-)+ Ed+®Yd- ® R1-C(-R2)-Y-O-+E+ ® R1-C(-R2)-OE-Y
Образование кеталей и полукеталей: CH3®Cd+=Od-(-CH3)+Hd+®Od-C2H5 «H+ H3C-C(-OH)-(O-C2H5)-(CH3) (полукеталь) +H+ ® H3C-C-(OH)-CH3-(O-C2H5) +Hd+®Od-C2H5 «H+ H3C-C-(O-C2H5)2-CH3 (кеталь) +H2O
Восстановление: R1®Cd+(-R2)=Od-(кетон) ®[H] R1-CH(-OH)-R2 (втор.одноат.спирт)
Окисление кетонов происходит сложнее,с разрывом углеродной цепи и образованием 2х кислот,либо кислоты и кетона с более короткими цепями.
Присоединение-отщепление: R1®Cd+=Od-(-R2) (этиламин) +H-Nd-H-C2H5 ®H+ R2-(R1)-C=N-C2H5 (имин) +H2O
Карбоновые кислоты
Карб.к-ты- производные УВ,в котором один или более атомо замещены карбоксильной группой –COOH
Представители: (насыщенные) – HCOOH - метановая(муравьиная)к-та.Содержится в крапиве и выделениях муравьёв.Припопадении на кожу вызывает ожоги. – H3C-COOH - этановая(уксусная)к-та.естественныйметаболит,продукт уксуснокислого брожения сахаров. В медицине исп. в виде солей. - H3C- H2C- H2C –COOH- бутановая(масляная)к-та.Имеет неприятный запах,содержится в поте. (ненасыщенные) –пропеновая(акриловая)к-та.Её эфиры используются в производстве пластмасс для медицинского приборостроения.
Электронное строение: карб.группа является сопряжённой системой, в которой неподелённая пара эл. атома кислорода ОН-группы вступает в сопряжение с p-св.=> атом углерода в карб.группе,приобретая частичный +зар. +d,становится электрофильнымцентром,он атакует нуклеофильные реагенты.
Диссоциация: R®COOH+H2O«R-COO-+H3O+
Образование солей: R-COOH+NaOH«R-COONa+H2O
Р-иянуклефилльного замещения(SN): R1®Cd+(®:OH)=Od- (субстрат)+:Y -(нуклеофил)® R-C(-Y)-OH(-O -)(промежуточный продукт)® R-C=O(-Y)+:OH -(уходящая группа)
Образ.хлорангидридов:): R®Cd+(-OH)=Od-+P:Cl5 ® R-C-Cl(=O)+POCl3+HCl
Образ.амидов: R®Cd+(-Cl)=Od-+H-NH2 ® R-C=O(-NH2)+HCl
Образ.слож.эфиров: R1®Cd+(-OH)=Od-+H:O-R2 «H+ R1-C=O(-O-R2)+H2O
Образ.ангидридов: R1®Cd+(-OH)=Od-+HO-C(=O)-R2 ®P2O5 R1-C(=O)-O-C(=O)-R2+H2O
26.Дикарбоновые к-ты:это соединения с двумя карбоксильными группами.
1.Декарбоксилирование- превращение дикарбон. К-ты в монокарбоновую с выделением углекислого газа.
Для организма важно ферментативноедекарбоксилирование: НООС-СН2-СООН(малоновая к-та)→
СО2+НООС-СН3(уксусная к-та)
2.образование циклических ангидридов в результате внутримолекулярного отщепления воды:
Н2С-С=О-ОН—Н2С-С=О-ОН(янтарная к-та)→(t) Н2С-С=О—О- Н2С-С=О(ангидрид янтарной к-ты)+Н2О
27.ококислоты-это соединения, содержащие одновременно карбоксильную и карбонильную группы:
1.альдегидокислоты: НСОО-С=О-Н(глиоксиловая к-та, содержится в недрозрелых фруктах)
2.кетонокислоты Н3С-С=О-СООН(пировиноградная к-та, промежуточный продукт молочнокислого и спиртового брожения углеводов)
Н3С-С=О-СН2-СООН(ацетоноуксусная к-та образуется в организме в процессе метаболизма высших жирных кислот и при окислении β-гидроксимаслянойкислоты.Накапливается у больных сахарным диабетом)
Гидроксикислоты- соединения, содержащие одновременно карбоксильную и гидроксильную группы:
НО-СН2-С=О-ОН(2-гидроксиэтановая, гликолевая, содерж. в растениях, свекле, винограде)
Н3С-СН(ОН)-СООН (2-гидроксипропановая,молочная.продукт молочнокислого брожения в организме.При работе накапливается в мышцах, вызывая боль)
НО-СН2-СН2-СН2-СООН (у-гидроксимасляная,ГОМК,4-гидроксибутановая.оказывает наркотическое действие.применяется в виде Na соли как снотворное, неингаляционного наркотич.ср-ва в анастезиологии)
Н3С-СН(ОН)-СН2-СООН (в-гидроксимасляная,3-гидроксибутановая.промежут. продукт жирных кислот.накапливается у больных сах.диабетом)
При нагревании от двух молекул а-гидроксикислот отщепляется 2 молек. Воды и образуется лактид
При нагревании в-гидроксикислот происходит внутримолек. Отщепление воды.образуется ненасыщенная к-та
При нагревании у-гидроксикислот происходит внутримолек. Отщепление воды, но при участии спиртовой и карбоксильной групп.образуется циклическое соединение-лактон.
28. высшие насыщенные карбоновые кислоты: пальмитиновая С15Н31СООН, стеариновая С17Н35СООН
Ненасыщенные: олеиновая С17Н33СООН(одна=), линолевая С17Н31СООН(две=), арахидоновая С19Н31СООН(четыре =)
Ж.К.К при взаимодействии с трехатомным спиртом глицерином образуют сложные эфиры-ацитилглицерины или глицериды.
В зависимости от числа ОН- групп глицерина, вступивших в р-ю ацилирования, различают моно, ди, триацилглицерины.
29. углеводы-органические вещества, содержащие карбонильную группу и несколько гидроксильных групп. Углеводы играют чрезвычайно важную роль в питании человека. Углеводы являются важнейшим источником энергии для организма, которая необходима для обеспечения жизнедеятельности каждой клетки человеческого организма.Углеводы подразделяются на моносахариды или простые сахара-простейшие углеводы, не гидролизующиеся с образованием более простых углеводов.Олигосахариды-углев., при гидролизе которых образуется до 2 моносахаридов. Полисахариды-высокомолек. Углев., при гидролизе которых образ. Сотни и тысячи моносахаридов.
Моносахариды – это полигидроксикарбонильные соединения, в которых каждый атом углерода (кроме карбонильного) связан с группой ОН. Общая формула моносахаридов – Сn(H2O)n, где n =3-9.
По химическому строению различают:
альдозы – моносахариды, содержащие альдегидную группу;
кетозы – моносахариды, содержащие кетонную группу (как правило, в положении 2).
В зависимости от длины углеродной цепи моносахариды делятся на триозы, тетрозы, пентозы, гексозы и т.д. Обычно моносахариды классифицируют с учетом сразу двух этих признаков, например:

В природе встречаются производные моносахаридов, содержащие аминогруппу (аминосахара), карбоксильную группу (сиаловые кислоты, аскорбиновая кислота), а также атом Н вместо одной или нескольких групп ОН (дезоксисахара). Пентозы:


30.начало в вопросе 29. Гексозы: содержащие 6 атомов углерода; широко распространены в природе — содержатся в растительных и животных тканях как в свободном виде, так и в составе полисахаридов. Г., содержащие в молекуле альдегидную группу, относятся к альдозам (глюкоза, манноза, галактоза), кетонную — к кетозам (фруктоза). Наиболее важны глюкоза и фруктоза. Г. служат сырьём для многих видов микробиологической промышленности (производство молочной кислоты, ацетона, глицерина)

31.Циклические формы моносахаридов и их образования.
Циклическая


Шестичленный цикл называется пиранозным.
Пятичленный цикл фуранозным.


Приведенные циклические формулы моносахаридов называются формулами Хеуорса.
d-ГЛЮКОПИРАНОЗА


Цикло-оксо-таутомерия- способность моносахаридов существовать в виде равновесной смеси открытой и циклической.

32.химичкские св-ва моносахаридов
О-гликозиды


N-Гликозиды

Простые Эфиры
Сложные эфирны:

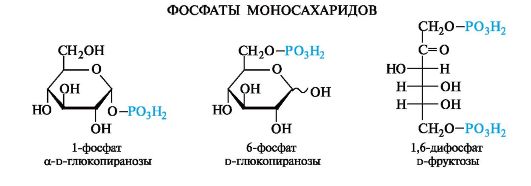
33.Хим. св-ва моносахаридов. Восстановление моносахаридов.
Окисление моносахаридов:
Глюконовая кислота

Гликаровая кислота

Гликуроновая кислота

34.Сложные углеводы. Классификация сл углеводов. Дисахариды
Сложные углеводы:
1. Олигосахариды, при гидролизе которых образуются от 2 до 10молекул моносахаридов, и полисахариды, при гидролизе которых образуются сотни и тысячи молекул.
2. Гомополисахариды, гидролизующиеся с образованием моносахаридов одного вида, и гетерополисахариды, гидролизующиеся с образованием различных моносахаридов.
Дисахариды – это углеводы, молекулы которых состоят из двух различных или одинаковых моносахаридных звеньев.

Мальтоза- солодовый сахар- основной продукт расщепления крахмала ферментов, выделяемым слюнной железой.
Состоит из остатков α-Д-глюкопиранозы и α-(или β)- Д-глюкопиранозы связанных α‑1,4‑гликозиднойсвязью. Первый моносахарид всегда явл. α-аномером.
Целлобиоза- в чистом виде встречается редко. Является фрагментом целлюлозы и обр. при не полном гидролизе этого полисахарида.
Состоит из остатков β-Д-глюкопиранозы и α-(или β)- Д-глюкопиранозы связанных β‑1,4‑гликозиднойсвязью.. Первый моносахарид β-аномером
 лактоза - молочный сахар.
лактоза - молочный сахар.
Состоит из остатков β-Д-галактопиранозы и α-(или β)- Д-глюкопиранозы связанных β‑1,4‑гликозиднойсвязью.
 сахароза –содержится в сахарном тростнике, сахарной свекле, соков плодов и ягод. Состоит из остатков α-Д-глюкопиранозы и β- Д-фруктофуранозы связанных α‑1,2‑гликозиднойсвязью. Связь осуществляется за счет полуацетальных гидроксилов обоих моносахаридов.
сахароза –содержится в сахарном тростнике, сахарной свекле, соков плодов и ягод. Состоит из остатков α-Д-глюкопиранозы и β- Д-фруктофуранозы связанных α‑1,2‑гликозиднойсвязью. Связь осуществляется за счет полуацетальных гидроксилов обоих моносахаридов.
Цикло-оксо-таутомерия способность дисахаридов существовать в виде равновестной смеси открытой и циклических форм, характерной только для восстанавливающих дисахаридов.
Она обусловлена наличием в них свободной полуацетальной гидроксильной группы. Благодаря ей у дисахаридов сохраняется способность к раскрытию цикла с образованием альдегидной группы. Альдегидная группировка в определенных условиях может окисляться в карбоксильную. В связи с этим дисахариды и проявляют восстанавливающие способности.

Мутаротация- это изменение во времени угла вращения плоскости поляризации света. Она обусловлена: если вещество не обладает оптической способностью, то луч плоскополяризованного света, проходя через его раствор, не отклоняется от прямого направления. Если же вещество оптически активно, то луч, проходя через его раствор, отклоняется на определенный угол либо в правую сторону, либо в лево.
К восстанавливающим дисахаридом относятся: мальтоза, целлобиоза, лактоза.
Гидролиз дисахаридов:
Мальтоза + Н₂О α-Д-глюкоза+ α-(или β)- Д-глюкоза
Целлобиоза + Н₂О β-Д-глюкоза+ α-(или β)- Д-глюкоза
Лактоза+ Н₂О β-Д-галактоза+ α-(или β)- Д-глюкоза
Сахароза + Н₂О α-Д-глюкоза+ β- Д-фруктоза
35. Сложные углеводы. Классификация сл углеводов. Гетерополисахариды.
Сложные углеводы:
1. Олигосахариды, при гидролизе которых образуются от 2 до 10молекул моносахаридов, и полисахариды, при гидролизе которых образуются сотни и тысячи молекул.
2. Гомополисахариды, гидролизующиеся с образованием моносахаридов одного вида, и гетерополисахариды, гидролизующиеся с образованием различных моносахаридов.
Гомополисахариды–общее название гликаны.
Общая формула- (С6Н10О5)n
Целлюлоза (клетчатка) – растительный полисахарид, являющийся самым распространенным органическим веществом на Земле. Состоит из остатков только β-Д-глюкопиранозы, связанных β-1,4-гликозидными связями. 
Крахмал – это ассоциат двух гомополисахариднов: амилозы и амилопектина, связанных между собой водородными связями и построенных из остатков α-Д-глюкопиранозы. Образуется в процессе фотосинтеза в растениях и запасается в клубнях, корнях, семенах, является важным источником питания. В медицине его используют для изготовления присыпок, паст, таблеток.
Амилоза состоит из остатков α-Д-глюкопиранозы, связанных α-1,4-гликозидными связями.

Амилопектин –содержит от 6 тыс. до 9млн.Д-глюкозных остатков. В основной цепи α-Д-глюкопиранозные остатки связанны α-1,4-гликозидными связям, в точках разветвления - α-1,6-гликозидными связями. 
Гликоген или животный крахмал в животном организме является структурным и функциональным аналогом амилопектиновой фракции растительного крахмала. Строение такое же как у амилопектина, но гораздо разветвление.
Декстраны – полисахариды бактериального происхождения. Являются компонентом налета на зубах. Построены из α-Д-глюкопиранозных остатков. Макромолекулы их сильно разветвлены. Основной тип связи- α-1,6. В местах разветвления α-1,4; α-1,3;и реже α-1,2.
Их применяют при больших кровопотерях, при лечение ожогов и нефротических отеков.
36. сложные углеводы:
1)олигосахариды-при гидролизе которых образуются от 2 до 10 молекул моносахаридов.
полисахариды- при гидролизе которых образуются 100 и 1000 молекул.
2)гомополисахариды-гидролизующиеся с образованием моносахаридов одного вида.
Гетерополисахариды-гидролизующиеся с образованием моносахаридов разного вида(состоят из гепарина, хондроитинсульфатов,гиалуроновой кислоты)
Гепарин-естественный антикоагулянт, препятствует свертыванию крови,содержиться в малых количествах в печени,крови, легких и селезенке. Построен гепарин из повторяющихся дисахаридных фрагментов, связанных между собой α 1,4 или β 1,4- гликозидными связями. Каждый дисахаридный фрагмент содержит остатки Д-глюкозамина и двух уроновых кислот –Д- гликуроновой или L-идуроновой связанных 1,4-гликозидной связью.
Хондроитинсульфаты-содержится в соединительной ткани кожи, хрящей и сухожилиях. Они являются эфирами серной кислоты, построены эти соединения из повторяющихся дисахаридных фрагментов, связанных между собой β 1,4-гликозидными связями. Каждый дисахаридный фрагмент состоит из остатков β-Д-гликуроновой кислоты и N-ацетил-Д-галактозомина, связанных β 1,3-гликозидной связью.
Гиалуроновая кислота – содержится в пуповине, суставной жидкости и стекловидном теле глаз. Она выполняет роль межклеточной смазки, поэтому присутствует в сухожилиях, кожи и хрящях. Обладает высокой вязкостью, липкостью, обеспечивает непроницаемость соединитльной ткани для болезнетворных бактерий. В тоже время в присутвиигиалуроновой кислоты возрастает упругость ткани. Неразветвленные цепи гиалуроновой кислоты состоят из повторяющихся дисахаридных фрагментов,соединенных β 1,4 гликозидными связями. Дисахаридный фрагмент включает остатки β-Д-глюкуроновой кислоты и N-ацетил-Д-глюкозамина, связанных β 1,3-гликозидными связями:
Гликозидная природа полисахаридов обуславливает их легкий гидролиз в кислой среде и высокую устойчивость в щелочной. При этом при неполном, частичном гидролизе образуется смесь олигосахаридов в том числе и дисахаридов. При полном гидролизе образуются моносахариды или их производные.
Первичная структура – определенная последовательность остатков моносахаридов в полисахаридной цепи.
Вторичная структура- расположение макромолекулярной цепи в пространстве. Полисахаридные цепи могут быть разветвленные и неразветвленные(линейные), спиральные. Высокомолекулярные полисахариды по физическим свойствам отличаются от низкомолекулярных полисахаридов и моносахаридов, они не исеют сладкого вкуса, не кристаллизуются из растворов, плохо растворимы в воде(кроме гликогена), образуют колоидные растворы. Способны к набуханию и застудневанию.
37.  аминкислоты- это гетрофункциональные соединение.Они содержат одновременно карбоксильную и аминогруппу, которые находяться у одного и того же α-углеродного атома.
аминкислоты- это гетрофункциональные соединение.Они содержат одновременно карбоксильную и аминогруппу, которые находяться у одного и того же α-углеродного атома.
Классификация: 1) по химической природе радикала: Ациклические(алифатические)(гли,ала,вал); Циклические:а)ароматические(фен,тир) б)гетероциклические(Гис)
2) По наличию функциональных групп или по кислотно-основным свойствам:1)Моноаминомонокарбоновые,илинетральные – все кислоты,указанные выше 2)Моноаминодикарбоновые, или кислые(Асп,Глу)3)Диаминомонокарбоновые,или основные(Лиз)
3) По полярности радикалов: 1)Неполярные-в радикалах не содержатся дополнительные функциональные групп.Это алифатические аминокислоты 2)Полярные.В радикалах содержатьсяядополгительные функциональные группы – ОН,SH,S и др.(Сер,Мет,Цис)
Изоэлектрическая точка-значение pH, при котором концентрация биполярных ионов максимальна, а концентрация катионных и анионных форм равны между собой.
У нейтральных кислот ИЭТ лежит в области нейтрального значения pH. Однако, несколько ниже pH=7 из-за большей способности к диссоциации карбоксильной группы(ИЭТ=7).
Кислые α-аминокислоты имеют в радикале дополнительную карбоксильную группу. В водной среде они находятся в анионной форме. Для них изоэлектрическое состояние наблюдается в силь кислой среде, т.е. изоэлектрической точке соответствуют значения pH>7:
Основные α-аминокислоты имеют в радикале дополнительную аминогруппу. В водной среде они находятся в катионной форме. В этом случае изоэлектрическое состояние наблюдается в сильно щелочной среде. Т.е. изоэлектрической точке соответствует значение pH>>7:
Все аминокислоты, кроме глицина-оптически активны. Они имеют один или два ассиметричных центра(атома углерода с четырьмя различными заместителями) и могут существовать в виде энантиомеров Д- или L-ряда.Для определения принадлежности к Д- или L-рядам сравнивают расположение NH2-группы у хирального центра в аминокислоте с расположением OH-группы в стандарте- глицериновом альдегиде:
Белки человеческого и животных организмов построены из α-аминокислот L-ряда. Д-α-аминокислоты встречаются в природе редко и человеческим организмом не усваиваются.Они входят в состав белковой клеточной стенки бактерий сибирской язвы,против которых больные бессильны расщепляющие ферменты человека и животных.
Амфотерные, т.к. содержат в своих молекулах функциональные группы кислотного COOH и щелочного NH2 характера. В водных растворах диссоциируют.При этом в зависимости от pH среды α-аминокислота может существовать в виде равновесной смеси биполярного иона, катионной и анионной форм:
Также амфотерность проявляется в способности взаимодействовать какс сильными кислотами, так и со щелочами с образованием солей.
Особенности химических свойств α,β,γ-аминокислот:
а) α-аминокислоты при нагревании реагируют между собой с выделением двух молекул воды и образованием дикетопиперазина:
б) β-аминокислоты при нагревании внутримолекулярно отщепляют молекулу аммиака с образованием ненасыщенных кислот(неокислительное дезаминирование):
в) γ-аминокислоты при нагревании также внутримолекулярно отщепляют молекулу воды и образуют внутренние циклические соединения-лактамы:
38.Специфицеские реакции протекают, преимущественно, ферментативным путем:
А) Декарбоксилирование- по этому пути в организме из α-аминокислот образуются амины.ю называемые биогенными.Определяет функционирование цикла Крепса, большое значение имеет для обмена веществ и гниения:
Б) Переаминирование(трансминирование- реакция переноса аминогруппы от аминокислоты к кетонокилоте.В организме эта реакция является основным путем биосинтеза α-аминокислот из α-кетонокислот:
В) Дезаминирование- регуляция в организме(снижается избыток) α-аминокислот:
1) неокислительноедезаминирование протекает без участия кислорода, с образованием ненасыщенных кислот:
2)окислительное дезаминирование осуществляется при участии кофермента НАД+ с образованием α-кетонокислот:
Г) Вне организма дезаминирование α-аминокислот осуществляется под действием азотистой кислоты с образованием α-гидроксикислот.Выделяется газообразный азот, по его обьему определяют кол-во аминокислоты, вступившей в реакцию, используется в аналитических целях(метод Ван-Слайка):
Д)Метод формольного титрования- аналитический метод для количественного определения α-аминокислот. Формальдегид взаимодействует с аминогруппой α-аминокислоты, защищает ее, свободную карбоксильную группу оттитровывает полностью:
Ж)Для качественного определения α-аминокислот используется реакция с гидроксидом меди(2). При этом образуются внутрикомплексные(хелатные) соли меди синего цвета:
39.Белки,пептиды- природные или синтетические полимеры. Построены из остатков α-аминокислот,соединенных пептидными или амидными связями.Пептиды по молекулярной массы меньше белков.Петиды содержат в молекуле до 100, а белки – свыше 100 аминокислотных остатков.Пептиды подразделяют на олигопептиды и полипептиды.Олигопептиды включают до 10, а полипептиды- от 10 до 100 остатков аминокислот.
Белки по составу разделяют на: 1) простые-гидролизуются с образованием только α-аминокислот.
2)сложные- кроме белковой части, состоящей из α-аминокислот, содержат также органическую или неорганическую часть небелковой часть небелковой природы(простетическая группа).
По типу простетической группы:1)гемопротеины-белковая часть,глобин соединена с простетической группой гемом(гемоглобин,миоглобин)
2)фосфопротеины-в качествепростетической группы содержат остаток фосфорной кислоты
3)металлопротеины- ионы металла
К сложным белкам относят смешанные биополимеры- молекулы содержат кроме белковой части простетическую группу липидного характера(липопротеины),углеводного характера(гликопротеины) и т.д.
По пространственной структуре: 1)Глобулярные- растворяются в воде и солевых растворах с образованием коллоидных систем.Для них более характерна α-спиральная структура.Макромолекула в форме сферы.Это яичный белок, миоглобин,почти все ферменты.
2) Фибрилярные- часто имеют волокнистое строение,не растворяются в воде.Для них более характерна β-структура.Это –кератин волос и роговой ткани, миоинозин мускульной ткани,коллаген соединительной ткани.
Строение белков и пептидов: Белковая и пептидная молекулы являются продуктом поликонденсации α-аминокислот, этот процесс сопровождается образованием пептидных или амидных связей между мономерными звеньями. Конструкция остова полиамидной цепи одинакова для всех белков и пептидов. Имеет неразветвленное строение и состоит из чередующихся амидных связей- CO-NH и CH-групп.
Строение цепи: 1)N-конец, на котором находится аминокислота со свободной NH2-группой. Она записывается слева и является началом цепи.
2) Последовательность чередующихся CH-групп с отходящими от них боковыми радикалами R и амидных связей
3) C-конец, имеющий аминокислоту со свободной COOH-группой.Он записывается справа и является концом цепи:
Нейтральный белок- имеет по одной свободной NH2- и COOH-группе. Его ИЭТ соответствует значение pH=7
Кислый белок- преобладают свободные СOOH-группы. Его ИЭТ соответствует значение pH<7.
Основный белок-преобладание свободной группы NH2, его ИЭТ соответствует значение pH>7.
В организме человека большинство пептидов и белков-кислые. Их ИЭТ точка лежит между значениями pH 4 и 7.
Строение пептидной группы бывает электронным и пространственным. Атом углерода в пептидной или амидной группе –С-NH=O находиться в sp2-гибридизированном состоянии. Неподеленная пара электронов атома азота вступает в сопряжение с π-электронами двойной связи группы =С=O. При этом образуется трехцентроваяp, π-сопряженная система.Электронная плотность в ней смещена к более электроотрицательному атому кислорода:
Первичная структура белка- определяется тем, какие аминокислоты и в какой последовательности входят в состав полипептидной цепи.Замена одной может вызвать необратимые последствия(замена кислоты в белковой цепи гемоглобина, состоящей из 146, ведет к серповидной анемии.Стабилизируют амидные и пептидные связи. Она не дает представления о пространственном строении белков.
Вторичная-определяет пространственную форму основной, единичной полипептидной цепи. Различают α-спираль и β-складчатую конформации.Пространственное расположение  -спирали можно представить, как она обвивает некий цилиндр, а боковые радикалы α-аминокислот находятся на наружной стороне спирали и направлены от поверхности цилиндра.Обычно спирализованы не полностью,а участками.β-складчатая представляется в виде листа свернутого гармошкой. Стабилизация идет засчёт водородных связей, которые образуются между элементами пептидных связей и радикплами на близких расстояниях друг от друга.
-спирали можно представить, как она обвивает некий цилиндр, а боковые радикалы α-аминокислот находятся на наружной стороне спирали и направлены от поверхности цилиндра.Обычно спирализованы не полностью,а участками.β-складчатая представляется в виде листа свернутого гармошкой. Стабилизация идет засчёт водородных связей, которые образуются между элементами пептидных связей и радикплами на близких расстояниях друг от друга.
Третичная структура –полипептидная цепь, имеющая первичную и вторичную структуры, способна располагаться в пространствеопределеннымобразом.Стабилизация за счетводородных и дисульфидныхсязей, гидфобного и электростатического взаимодействия.Взаимодействуют как близко лежащие так и удаленные группы атомов.
Четвертичная структура- полипептидные цепи, способные образовывать сложные комплексы или агрегаты, сохраняя первичную,вторичную,третичную структуры.Стабилизация-водородные,дисульфидные,гидрофобные,электростатические взаимодействия между суебъединичными полипептидными цепями.
Денатурация-разрушение природной пространственной структуры белка под влиянием различных факторов.При этом сохраняется только первичная структура, биологическая активность утрачивается.Факторы: изменение температуры,pHсреды,УФ- и рентгеновские излучения, механическое воздействие.Денатурация бывает обратимой(в холодильнике хранение яиц) и необратимой(варка яиц).Необратимая (ренатурация) вызывает в структуре белков изменения, которые легко и быстро устраняются.
Гидролиз: В щелочной среде не используеся, т.к. разрушаются сами аминокислоты.При килом гидролизе пептидные связи разрушаются, из-за этого образуются короткие пептидные цепи(частичный гидролиз),смесь α-аминокислот, из которых он был построен(полный гидролиз).Ферментативный гидролиз катализируется ферментами-пептидазами.Так проводят частичный гидролиз.В организме белки пищи гидролизуются полностью,т.к. для жизнедеятельности используется только свободные α-аминокислоты.
 2018-01-21
2018-01-21 1232
1232







