Все элементы этой группы являются металлами. Наружные электронные оболочки(n-1)s2 (n-1)p6(n-1)d10 ns2
радиус увеличивается. Все три металла имеют сравнительно низкие температуры плавления и кипения, что говорит о том, что металлическая связь относительно слабая/
цинк сходен с медью по свойствам медью.
Zn
при нормальных условиях — хрупкийметалл голубовато-белого цвет.
Легко покрывается оксидкой пленкой состоящей из смеси ZnO,Zn(OH)2,(ZnOH)2CO3
t(плавления)=420.плотность7.13г/мл,средний уровень электро-,теплопроводности
Достаточно мягкий пластичный.Не подвергается коррозии
Соединения цинка амфотерны.В природе встречается ZnS-цинковая обланка, ZnCo3-галмей
ZnS+2O2=ZnO+SO3,, ZnO+CO=(t)Zn+CO2. ZnO+H2.=(t,p)Zn+H2O
Металл ср.активности.
Zn+Cl2=ZnCl2.. 2Zn+O2=(t)2ZnO, Zn+S=(t)ZnS,
С кислотами:  …Zn+2CH3COOH=(CH3COO)2Zn+H2
…Zn+2CH3COOH=(CH3COO)2Zn+H2
C HNO3: 3Zn+8HNO3(Разб)=3Zn(NO3)2+2NO+4H2O
Zn+ HNO3(Конц)= Zn(NO3)2+2NO2+H2O
Взаимодействие с конц H2SO4 протекает по разному(зависит от степени концентрации и t)
4Zn+5 H2SO4 (конц)=(t)4ZnSO4+H2S+4H2O(85-97%)
3Zn+ 4H2SO4 (конц)=(t)3ZnSO4+S+4H2O(50-85%)
Zn+ 2H2SO4 (конц)=(t) ZnSO4+SO2+H2O(меньше 50%)
Zn-амфотерен.поэтому растворяется в щелочи образуя комплексы:Zn+NaOH+2H2O=Na2[Zn(OH)4]+H2(тетрагидроксоцинкат)
Zn+Mno2+NH4Cl=ZnCl2+[Zn(NH3)4]Cl2+MnO(OH)2
Zn + 4NH3·H2O = [Zn(NH3)4](OH)2 + 2H2O + H2
Оксид гидроксид цинка проявляют выраженные амфотерные свойства. реагируЕт с сильными кислотами,образуя соли этих кислот.(основных свойств амфотерных оксидоВ) ZnO + H2SO4 → ZnSO4 + H2O
Они также реагируют с сильными щелочами,(кислотные свойства,)
ZnO + 2NaOH → Na2ZnO2 + H2O(в расплаве)
ZnO + 2NaOH + H2O → Na2[Zn(OH)4](в растворе)
ZnO+Na2O=(t)Na2ZnO2
Zn(NO3)2+2NaOH=Zn(OH)2(белый осадок)+2NaNo3
Zn(OH)2+ 2NaOH → Na2[Zn(OH)4](в растворе)
Zn(OH)2+NaOH → Na2ZnO2 + H2O(в расплаве)
Zn(OH)2+2BaOH→ Ba2[Zn(OH)6]
Zn(OH)2+Na2O=(t)Na2ZnO2+H2O
Zn(OH)2+4NH3=[Zn(NH3)4](OH)2
В медицине:Zn-один из наиболее важных эссенциальных микроэлементов(участвует в обмене веществ)содержание а организме2-4 гр,сут доза-15-20млгр,содердится в печени,молоке,яйцах,некоторых зерновых продуктах
Входит в состав 40 ферментов:1Карбоангидраза(в белках,мембране эритроцитов,катализируют превращение CO2 в уогльную кислоту)
2карбоксипептидаза(катализируют гидролиз определенных пептидных связей белков)
Входит состав инсулина(меняет структуру белка инсулина)
Препараты:цинкинсулин-регулирует уровень глюкозы в крови
ZnSO4*7H2O Цинковый купорос- вяжущее средство.антисептик
ZnO-из него делают разные присыпки,мази
Цинковая мазь,паста цинковая,паста цинко-салициловая(жаропонижающее,противовоспалительное)
Линимент окиси цинка(вяжущее,противвоспалительное)
РТУТЬ
Малоактивный металл.Т.к в атоме f-сжатие,он обладает низкой активность и маленьким радиусом.
Ртуть единственный жидкий металл в природе
t(плавления)-38,плотность-15.7г/мл. обладает электропроводностью
очень устойчив к действию влажной среды,легко образует амальгамы(сплавы)с металлами.амальгамы олова и серебра применяются как пломбировочные.с железом не образует амальгамы.
Пары ртути оч ядовиты.
Ртуть нейтрализуют демеркуризаторами:
-обработать порошком серы,обработать20%раствором FeCl3,10%раствором перманганата подкисленным HCl.эмульсия минерального масла в воде.
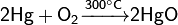 .
. 
2Hg+Cl2=(t)2HgCl2-сулема
HgCl2+Hg=(t)Hg2Cl2-каломель
Hg+HNO3(разб охлажд)=(t)Hg2(NO3)2+2NO+4H2O
 (в конц)
(в конц)
Hg не образует гидроксидов!
Соединения ртути 2+
Hg(NO3)2+2HCl=HgO+2NaNO3+H2O(желтый осадок)
Hg(NO3)2+2NaCl=HgCl2+Na2SO4(белый осадок)
Hg(NO3)2+H2O=Hg(OH)NO3+HNO3
Hg(OH)NO3=HgO*Hg(NO3)2+H2O.
Качественной реакцией на 2хвалентную ртуть явл.
-образование осадков с сульфидами и йодидами
Hg(NO3)2+Na2S=HgS(красно-корич)+2NaNo3/
Hg(NO3)2+2NaY=HgY2(морковно-красный)+2NaNo3
HgY2+2NaY=Na2[HgY4](тетраиодомеркуриат)
HgS+Na2S=Na2[HgS2]
Na2[HgY4]+NH3+KOH=Ho-Hg-NH3-Hg-Y(желтокоричн осадок)+KY+H2O
HgCl2+NH3=HgNH3Cl+NH4Cl(амидохлорид)
Hg2Cl2+NH3=HgNH3Cl+Hg(темносер осадок)+NH4Cl
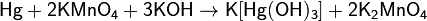
 2018-01-21
2018-01-21 760
760








