Важнейшим свойством ферментов является преимущественное ускорение одной из нескольких теоретически возможных реакций. Это позволяет субстратам выбрать наиболее выгодные для организма цепочки превращений из целого ряда возможных путей.
В зависимости от условий ферменты способны катализировать как прямую, так и обратную реакции. Например, пировиноградная кислота под влиянием фермента лактатдегидрогеназы превращается в конечный продукт брожения — молочную кислоту. Этот же фермент катализирует и обратную реакцию, и само название он получил не по прямой, а по обратной реакции. Обе реакции происходят в организме при разных условиях:

Это свойство ферментов имеет большое практическое значение.
Другое важное свойство ферментов — термолабильность, т. е. высокая чувствительность к изменениям температуры. Мы уже говорили, что ферменты являются белками. Для большинства из них температура свыше 70 °С приводит к денатурации и потере активности. Из курса химии известно, что повышение температуры на 10 °С приводит к увеличению скорости реакции в 2—3 раза, что характерно и для ферментативных реакций, но до определенного предела. При температурах, близких к 0 °С, скорость ферментативных реакций замедляется до минимума. Это свойство широко используется в различных отраслях народного хозяйства, особенно в сельском хозяйстве и медицине. Например, все существующие сейчас способы консервации почки перед ее пересадкой больному включают охлаждение этого органа, чтобы снизить интенсивность биохимических реакций и продлить время жизни почки до ее пересадки человеку. Такой прием сохранил здоровье и спас жизнь десяткам тысяч людей в мире.
|
|
|

Рис. 2. Влияние pH на активность ферментов.
Одним из важнейших свойств белков-ферментов является их чувствительность к реакции среды, концентрации водородных ионов или гидроксид-ионов. Ферменты активны только в узком интервале кислотности или щелочности среды (pH). Например, активность пепсина в полости желудка максимальна при pH около 1 —1,5. Снижение кислотности приводит к глубокому нарушению пищеварительного акта, недоперевариванию пищи и тяжелым осложнениям. Из курса биологии вам известно, что пищеварение начинается уже в ротовой полости, где присутствует амилаза слюны. Оптимальное значение pH для нее 6,8—7,4. Для разных ферментов пищеварительного тракта характерны большие различия в оптимуме pH (рис. 2). Изменение реакции среды приводит к изменению зарядов на молекуле фермента или даже в его активном центре, вызывая снижение или полную потерю активности.
Следующим важным свойством является специфичность действия фермента. Каталаза расщепляет только пероксид водорода, уреаза — только мочевину H2N—СО—NH2, т. е. фермент катализирует превращение только одного субстрата, только его молекулу он «узнает». Такая специфичность считается абсолютной. Если фермент катализирует превращение нескольких субстратов, имеющих одинаковую функциональную группу, то такая специфичность называется групповой. Например, фосфатаза катализирует отщепление остатка фосфорной кислоты:
|
|
|

Разновидностью специфичности является чувствительность фермента только к одному изомеру — стерео-химическая специфичность.
Ферменты влияют на скорость превращения различных веществ. Но и на ферменты влияют некоторые вещества, резко изменяя их активность. Вещества, которые повышают активность ферментов, активизируют их, называются активаторами, а угнетающие их — ингибиторами. Ингибиторы могут подействовать на фермент необратимо. После их действия фермент уже никогда не может катализировать свою реакцию, так как его структура будет сильно изменена. Так действуют на фермент соли тяжелых металлов, кислоты, щелочи. Обратимый ингибитор может быть удален из раствора, и фермент вновь приобретает активность. Такое обратимое ингибирование часто протекает по конкурентному типу, т. е. за активный центр борются субстрат и похожий на него ингибитор. Снять такое ингибирование можно, если увеличить концентрацию субстрата и вытеснить ингибитор с активного центра субстратом.
Важным свойством многих ферментов является то, что они находятся в тканях и клетках в неактивной форме (рис. 3). Неактивная форма ферментов называется проферментом. Классическими его примерами являются неактивные формы пепсина или трипсина. Существование неактивных форм ферментов имеет большое биологическое значение. Если бы пепсин или трипсин вырабатывались сразу в активной форме, то это приводило бы к тому, что, например, пепсин «переваривал» стенку желудка, т. е. желудок «переваривал» сам себя. Такого не происходит потому, что пепсин или трипсин становятся активными только после попадания в полость желудка или в тонкий кишечник: от пепсина под действием соляной кислоты, содержащейся в желудочном соке, отщепляется несколько аминокислот, и он приобретает способность расщеплять белки. А сам желудок предохранен теперь от действия пищеварительных ферментов слизистой оболочкой, выстилающей его полость.
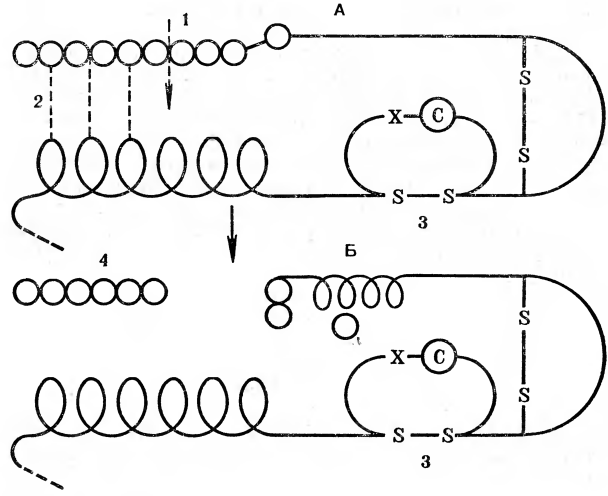
Рис. 3 Схема превращения трипсиногена в активный трипсин: А — трипсиноген; Б — трипсин; 1 — место отрыва пептида; 2 — водородные связи; 3 — дисульфидный мостик; 4 — пептид, отщепленный при активации.
Процесс активации фермента идет, как правило, одним из четырех путей, представленных на рисунке 4. В первом случае отщепление пептида от неактивного фермента «открывает» активный центр и делает фермент активным.

Рис. 4 Пути активации ферментов (штриховкой отмечена молекула субстрата):
1 — отщепление от профермента небольшого участка (пептида) и превращение неактивного профермента в активный фермент; 2 — образование дисульфидных связей из SH-групп, освобождающее активный центр; 3 — образование комплекса белка с металлами, активирующее фермент: 4 образование комплекса фермента с каким-нибудь веществом (при этом освобождается доступ к активному центру).
Второй путь представляет собой образование дисульфидных S—S-мостиков, делающих доступным активный центр. В третьем случае присутствие металла активирует фермент, который может работать только в комплексе с этим металлом. Четвертый путь иллюстрирует активацию каким-то веществом, которое связывается с периферическим участком белковой молекулы и деформирует фермент таким образом, чтобы облегчить доступ субстрата к активному центру.
|
|
|
В последние годы обнаружен еще один способ регуляции активности ферментов Выяснилось, что один фермент, например лактатде-гидрогеназа, может находиться в нескольких молекулярных формах, отличающихся между собой, хотя они все катализируют одну реакцию. Такие различные по составу молекулы фермента, которые катализируют одну и ту же реакцию, встречаются даже внутри одной и той же клетки. Их называют изоферментами, т. е. изомерами фермента. У названной уже лактатдегидрогеназы найдено пять различных изоферментов. Какова роль нескольких форм одного фермента? Видимо, организм «подстраховывает» некоторые особенно важные реакции, когда при изменении условий в клетке работает то одна, то другая форма изофермента, и обеспечивает необходимую скорость и направление течения процесса.
И еще одно важное свойство ферментов. Часто они функционируют в клетке не отдельно друг от друга, а организованы в виде комплексов — ферментных систем (рис. 5): продукт предыдущей реакции — субстрат для последующей. Эти системы встроены в клеточные мембраны и обеспечивают быстрое направленное окисление вещества, «перебрасывая» его от фермента к ферменту. Синтетические процессы в клетке идут в подобных же ферментных системах.
 2018-01-21
2018-01-21 1651
1651








