Анод отливают из рафинируемого сплава, содержащего Ag, платиновые металлы и некоторые цветные металлы.

 Au HAuCl4, HCl, Au
Au HAuCl4, HCl, Au
(катод) H2O, примеси, с примесями
электролит (анод)
Золотохлористоводородная кислота (HAuCl4).
 HAuCl4 Au3+ + 4H++AuCl4 -
HAuCl4 Au3+ + 4H++AuCl4 -
(полностью диссоциирует).
 AuCl4 Au3+ + 4Cl-, но
AuCl4 Au3+ + 4Cl-, но
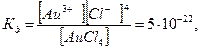 |
то есть равновесие смещено влево.
Возможен гидролиз AuCl4- в водном растворе:
 AuCl4- + H2O [AuCl3(OH)]- + H+ + Cl-.
AuCl4- + H2O [AuCl3(OH)]- + H+ + Cl-.
Но!! в кислом растворе гидролиз практически невозможен.
То есть Au в электролите находится в форме AuCl4-.
Основной катодный процесс:
 AuCl4- + 3e Au + 4Cl-.
AuCl4- + 3e Au + 4Cl-.
j0 = + 0,99 B.
Восстановление Н2 невозможно, так как j0Н+/Н2 = 0.
На аноде:
 Au + 4Cl- - 3e AlCl4-,
Au + 4Cl- - 3e AlCl4-,
так как стандартный j0 хлора и кислородa более электроположителен, чем j 0Au3+/Au .
 2Cl- - 2e Cl2(газ), j0 = + 1,36 B.
2Cl- - 2e Cl2(газ), j0 = + 1,36 B.
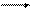 2H2O - 4e 4H+ + O2(газ), j0 = 1,23 B.
2H2O - 4e 4H+ + O2(газ), j0 = 1,23 B.
То есть их выделение в данном случае невозможно.
!!!Однако, Au склонно к пассивированию, что приводит к прекращению растворения золота,
j0 смещается в положительную сторону и становится возможным выделение Cl.
Это явление весьма нежелательно и далее опасно для работающих (Cl2).
|
|
|
Во избежание этого явления необходимо поддерживать повышенную кислотность, высокую температуру.
Повышение кислотности (свободной HCl) приводит к увеличению электропроводности электролита и, как следствие, к уменьшению расхода электроэнергии.
!! Другой особенностью электролиза Au является то, что на аноде кроме AuCl4- образуется AuCl2-:
 Au + Cl- - e AuCl2- ; j0 = +1,11B.
Au + Cl- - e AuCl2- ; j0 = +1,11B.
Так как электрохимический эквивалент Au+ > электрохимического эквивалента Au3+, то hA в расчете на Au3+ оказывается > 1000C. За счет реакции диспропорционирования:
 |
 3AuCl2- AuCl4- + 2Au + 2Cl-.
3AuCl2- AuCl4- + 2Au + 2Cl-.
Часть Au выпадает в шлам. Извлечение Au из шлама требует затрат, поэтому стремятся предотвратить образование порошкового Au. Это возможно с увеличением i.
!!! Третья особенность электрохимического рафинирования Au- это проведение электролиза при переменном ассиметричном токе (процесс Вольвиля). Для этого последовательно с постоянным током включают генератор переменного тока с ЭДС, превышающей ЭДС постоянного тока.
Рисунок 65.
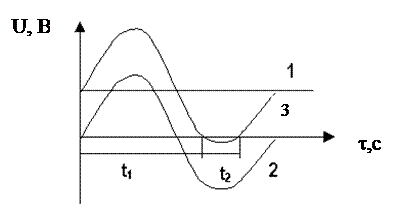 |
1- постоянный ток,
2- переменный ток,
3- ассиметричный ток
Рис. 65.
Необходимость применения ассиметричного тока вызвана специфическим поведением Ag при растворении анодного сплава.
Так как j0Ag (+ 0,799) < электроотрицателен, чем j0Au(+0,99), Ag легко окисляется на аноде, образуя AgCl:
 Ag + Cl- - e AgCl; j0 = +0,22B.
Ag + Cl- - e AgCl; j0 = +0,22B.
Если процесс ведут при постоянном токе, AgCl покроет анод толстой коркой, что приведет к прекращению растворения Au и выделению Cl2. При использовании ассиметричного тока на аноде чередуются полупериоды (+) знака (t1) с более короткими (-)(t2).
|
|
|
При анодной поляризации происходит растворение сплава и пленки AgCl. Во время катодной поляризации AgCl теряет сцепление с анодом и опадает на дно ванны (анодный шлам). Использование ассиметричного тока позволяет вести электролитное рафинирование Au c 20% Ag.
При этом Uпер : Uпост должно быть тем >, чем >Ag в сплаве.
Если содержание Ag менее 5 ¸ 6 %, электролиз можно вести при постоянном токе. AgCl не образует плотной пленки и опадает в шлам.
В анодном сплаве содержатся примеси: Cu, Pb, Bi, Te, Fe, Sn, As, Sb, Pt, Pd.
 2014-01-25
2014-01-25 754
754








