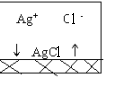
| Поскольку абсолютно нерастворимых веществ нет, какая - то часть AgCl перейдёт в раствор. Поскольку AgCl - сильный электролит, все молекулы, перешедшие в раствор, диссоциируют на ионы, и в растворе будут находится ионы. |
Любой раствор может быть насыщенным, ненасыщенным и перенасыщенным.
Ненасыщенным называют раствор, в котором при данной температуре можно растворить ещё какое - то количество данного вещества.
Насыщенным называют раствор, в котором скорость реакции растворения равна скорости реакции осаждения.
Концентрация насыщенного раствора для данного вещества при данной температуре есть величина постоянная, следовательно в насыщенном растворе концентрации ионов данного электролита являются константами.
Перенасыщенными называют растворы, которые содержат осадок.
Насыщенные растворы трудно растворимых электролитов характеризуется величиной, называемой произведением растворимости.
AB - трудно растворимый электролит
AB=A++B-
ПРАВ = [A+]*[B-] - насыщенный раствор,
|
|
|
ПРАВ > [A+]*[B-] - ненасыщенный раствор,
ПРАВ < [Ag+]*[B-] - перенасыщенный раствор.
Be(OH)3  Bi3++3OH-
Bi3++3OH-
ПРBi(OH)3 = [Bi3+]*[OH--]3.
Добавление в раствор одноимённых ионов труднорастворимого электролита способствует выпадению в осадок иона противоположного знака
PbSO4 = Pb2+ + SO42-
ПРPbSO4 = [Pb2+]*[ SO42-] = 2,2*10-1
Na2SO4 = 2Na+ + SO42-
[Pb2+]  .
.
 2014-01-31
2014-01-31 1116
1116








