При некоторой температуре в системе, образованной смешением SO2 и О2, установилось равновесие при концентрациях 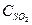 = 0,035моль/л,
= 0,035моль/л,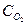 = 0,015моль/л и
= 0,015моль/л и 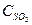 = 0,065моль/л. Вычислить константу равновесия и исходные концентрации веществ.
= 0,065моль/л. Вычислить константу равновесия и исходные концентрации веществ.
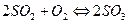
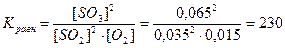 .
.
По уравнеию химической реакции 2 моль SO3 образуется из 2 моль SO2 и 1 моль O2, следовательно, 0,065 моль SO3 образовалось из 0,065 моль SO2 и 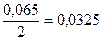 моль О2, тогда
моль О2, тогда
| ν, моль | SO2 | O2 | SO3 |
| νисх. | 0,1 | 0,0475 | |
| νистрач. | 0,065 | 0,0325 | - |
| νравн. | 0,035 | 0,015 | 0,065 |
Ответ: Кравн.= 230, Сисх.(SO2) = 0,1моль/л, Сисх.(О2) = 0,0474 моль/л.
 2014-01-31
2014-01-31 718
718








