Межмолекулярные взаимодействия.
Атом водорода, связанный с электроотрицательным атомом, способен образовывать водородную связь с электроотрицательным атомом другой молекулы.
Например, Н2О:
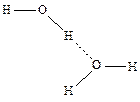
Водородная связь характеризуется незначительной энергией связи: Е = 10 ¸ 40 кДж/моль. Однако этой энергии достаточно, чтобы вызвать ассоциацию молекул, т.е. их ассоциацию в димеры или полимеры, которые в ряде случаев существуют не только в жидком состоянии вещества, но сохраняются и при переходе его в пар.
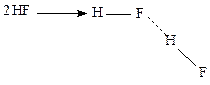 Например, фтороводород в газовой фазе существует в виде димера.
Например, фтороводород в газовой фазе существует в виде димера.
Образование водородной связи влияет на физические свойства элементов. Вещества с водородной связью обладают более высокой температурой кипения. Например, у воды аномально высокая температура кипения.
H2O – жидкость
H2S – газ
H2Se – газ
H2Te – газ
В сложных органических молекулах существуют внутримолекулярные водородные связи.
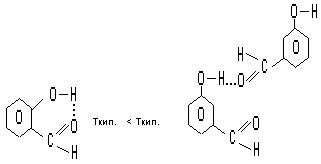 |
орто- гидроксибензальдегид мета- гидроксибензальдегид
внутримолекулярная межмолекулярная
|
|
|
водородная связь водородная связь.
Кроме водородных связей к основным видам взаимодействия относятся силы взаимодействия Ван-дер-Ваальса.
Вандерваальсовы силы – взаимодействие между молекулами. Природа этих сил электростатическая.
Основные силы взаимодействия:
1). Диполь – дипольное (ориентационное) взаимодействие существует между полярными молекулами.
 |
2). Индукционное взаимодействие осуществляется, если в веществе имеется контакт полярных и неполярных молекул. В неполярной молекуле индуцируется диполь в результате взаимодействия с полярной молекулой.
Cld+ - Cld- … Ald+Cld-3
3). Дисперсионное взаимодействие – это взаимодействие неполярных молекул за счет мгновенных диполей, возникающих за счет флуктуации электронной плотности в атомах.
 2014-01-31
2014-01-31 742
742








