О Г Л А В Л Е Н И Е
| Введение................................................... История развития атомной науки и техники...................... Строение атома и ядра, дефект массы, ядерные силы.............. Радиоактивность, закон радиоактивного распада................. Взаимодействие нейтронов с ядрами, сечения взаимодействия...... Замедление и диффузия нейтронов, зависимость сечений взаимодействия от энергии нейтронов............................. Заключение.................................................... Приложение ................................................... Библиографический список...................................... | 4 5 9 22 35 45 58 59 61 |
ВВЕДЕНИЕ
К основному оборудованию тепломеханической части паротурбинных атомных электрических станций относятся ядерный реактор, парогенератор (для двух- и трехконтурных АЭС) и турбина. Реакторная установка является ключевым элементом атомного энергоблока.
В настоящем учебном пособии рассматриваются физико-технические основы ядерной (атомной) энергетики. В части 1 данного пособия главное внимание уделено вопросам ядерной и нейтронной физики применительно к реакторным установкам АЭС.
Материал учебного пособия излагается с учетом уровня подготовки студентов выпускного курса вуза. Оно предназначено для их подготовки к итоговой государственной аттестации, в первую очередь, к защите выпускных квалификационных работ по тематике АЭС.
В Приложении приведен перечень наиболее часто употребляемых в литературе сокращений, в том числе и тех, которые использованы в данном учебном пособии. Список литературы, использованной при написании пособия, приведен в конце издания.
По дисциплинам «Ядерные энергетические установки» и «Тепловые и атомные электрические станции», преподаваемым кафедрой «Тепловые электрические станции» для студентов Казанского государственного энергетического университета (КГЭУ), подготовлены также электронные конспекты лекций. Они содержат более обширный материал и могут использоваться при подготовке к итоговой государственной аттестации.
1. ИСТОРИЯ РАЗВИТИЯ АТОМНОЙ НАУКИ И ТЕХНИКИ
Открытие и освоение ядерной энергии – это величайшее достижение человеческого разума, которое не было случайным, о чем свидетельствует вся история развития атомной науки и техники.
До начала прошлого столетия ученые считали, что вещество состоит из мельчайших неделимых частиц, названных атомами. Эта идея принадлежит древнегреческим мыслителям (Демокрит, V век до н. э.).
В основу атомно-молекулярного учения о строении вещества (А. Авогадро, Д. Дальтон, М.В. Ломоносов и др., XVIII-XIX вв.) легли фундаментальные положения о том, что все атомы одного элемента одинаковы и не могут создаваться или разрушаться в результате химических реакций, что окружающие нас сложные вещества представляют собой комбинации атомов нескольких элементов, причем соотношение числа атомов разных элементов в данном химическом соединении является постоянным независимо от количества вещества и т.д.
В конце XIX в. английские ученые В. Крукс и Дж. Томсон установили, что в состав атома входят некие отрицательно заряженные частицы, названные электронами. Это вытекало из результатов экспериментов с катодной трубкой.
В 1896 г. француз А. Беккерель обнаружил, что урановая руда испускает невидимые лучи, способные засветить фотобумагу, находящуюся в светонепроницаемом конверте. Это явление было названо радиоактивностью (т.е. лучевой активностью - от латинского «радиус», что означает «луч»).
Вскоре супруги Пьер Кюри и Мария Склодовская-Кюри открыли еще два радиоактивных элемента, названных радием и полонием. Последний из них получил свое наименование в честь Польши – родины М. Кюри.
Анализ состава радиоактивного излучения показал, что в состав атома входят не только электроны, но и положительно заряженные частицы.
В результате, Дж. Томсоном в 1898 г. была впервые предложена модель строения атома. Она заключалась в том, что атом состоит из положительно и отрицательно заряженных частиц, равномерно распределенных по его объему.
Однако уже через несколько лет, в начале двадцатого столетия, английский ученый Э. Резерфорд экспериментально установил, что основная масса атома сосредоточена в его центре. Такой вывод следовал из его опытов по бомбардировке атомов α-частицами, испускаемыми полонием, и он фактически означал открытие ядер атомов. В результате была предложена планетарная модель атома: в центре атома располагается положительно заряженное ядро, а вокруг него вращаются электроны - подобно тому, как Земля и другие планеты вращаются вокруг Солнца; ядро очень мало по сравнению с атомом, но в нем сосредоточена почти вся масса атома; заряд ядра и суммарный заряд всех электронов атома равны между собой (по абсолютной величине).
У этой модели есть серьезный недостаток. Она не объясняет, почему отрицательно заряженные электроны не падают на обладающее положительным зарядом ядро, как того требует закон Кулона. Кроме того, согласно законам электродинамики, электроны должны терять энергию излучения при своем вращении по круговым орбитам.
В эти годы появились и другие вопросы, неразрешимые в рамках классической механики. Например, в результате опытов А. Майкельсона было установлено постоянство скорости света - даже при движении источника этого света.
В рамках классической механики подобные противоречия объяснить невозможно.
Оказалось, что в микромире действуют свои законы. Усилиями целой плеяды выдающихся физиков (Н. Бор, Л. де Бройль, В. Гейзенберг, П. Дирак, М. Планк, Э. Шредингер и др.) в первые десятилетия XX в. были созданы основы новой науки – квантовой механики.
Фундаментальное значение имели идеи датского ученого Нильса Бора о закономерностях движения электронов в атоме. Развитие этих представлений привело к созданию квантовой теории строения атома, которая позволяет объяснить его устойчивость.
Состояние электрона в атоме характеризуется волновым уравнением Шредингера, из которого вытекает дискретность возможных значений энергии электрона. Следовательно, эта энергия не может быть меньше некоторого минимального уровня, что позволяет электрону оставаться на определенном расстоянии от ядра.
Выдающимся событием в развитии науки стало создание немецким ученым Альбертом Эйнштейном теории относительности, в которой коренным образом пересмотрены понятия пространства и времени и, в частности, установлена связь массы m и энергии E, а именно: E = mc 2, где c - скорость света.
В 1932 г. англичанин Дж. Чедвик обнаружил тяжелую ядерную частицу, не имеющую заряда. Ее назвали нейтроном. Сразу же после этого советский ученый Д. Иваненко и В. Гейзенберг (Германия) независимо друг от друга выдвинули предположение о том, что ядра атомов состоят из нейтронов и протонов - ядерных частиц с единичным положительным зарядом. Исключение составляет самый легкий изотоп водорода, в ядре которого имеется только один протон, а нейтронов нет.
Открытие нейтрона означало появление у физиков-экспериментаторов нового эффективного инструмента для исследования свойств ядер. Действительно, в отличие от заряженных частиц, нейтрон не отталкивается положительно заряженным ядром, как, например, протон или α-частица, и не тормозится на пути к ядру электронной оболочкой атома, как электрон.
В 1934 г. итальянский физик Э. Ферми обнаружил, что при бомбардировке ядер урана нейтронами образуются новые, более тяжелые ядра. Их стали называть трансурановыми. А через четыре года немцы О. Ган и Ф. Штрассман, повторившие эти опыты, сделали еще более важное открытие. Они зафиксировали появление элементов, находящихся в середине периодической таблицы Д.И. Менделеева.
Это означало не что иное как открытие деления урановых ядер нейтронами и привело к тому, что впоследствии назвали «атомной лихорадкой» - резкому увеличению числа работ в области ядерной и нейтронной физики.
В 1939-1940 гг. было установлено, что:
- реакция расщепления ядра урана сопровождается выделением огромной энергии;
- при делении одного ядра урана рождается количество нейтронов, достаточное для осуществления самоподдерживающейся, т.е. цепной реакции;
- существует явление спонтанного, т.е. самопроизвольного деления урана (в одном грамме происходит естественным образом деление одного ядра примерно раз в сто секунд).
Таким образом, была показана теоретическая возможность создания устройства, в котором может выделиться гигантская энергия за счет ядерной реакции деления урана нейтронами.
Ученые-ядерщики поняли, что появилась перспектива использования их научных достижений в военных целях. К этому времени уже началась вторая мировая война, в пожар конфликта втягивались все новые страны. Ряд ведущих ученых (А. Эйнштейн, Н. Бор и др.) эмигрировали из Европы за океан.
Это в немалой мере способствовало тому, что именно в США в декабре 1942 г. впервые в мире была осуществлена цепная ядерная реакция деления урана. Работами руководил итальянец Энрико Ферми, реактор располагался в подтрибунном помещении Чикагского стадиона.
В июле 1945 г. американцы провели испытание первой атомной бомбы, а через три недели, 6 и 9 августа, подвергли атомной бомбардировке японские города Хиросиму и Нагасаки.
В Советском Союзе еще в довоенное время проводились исследования в области деления урана, был создан определенный научный задел. В 1943 г. эти работы возобновились, и в декабре 1946 г. под руководством И.В. Курчатова состоялся пуск первого в Евразии ядерного реактора, а в 1949 г. мир узнал об успешном испытании первой советской атомной бомбы. Тем самым был положен конец монополии США на ядерное оружие.
Уже к 70-м годам прошлого столетия накопленных ядерных арсеналов хватило бы на многократное уничтожение всего живого на нашей планете. Ведущие ученые мира призывали правительства отказаться от гонки ядерных вооружений и поставить энергию атома на службу человечеству.
Игорь Васильевич Курчатов подчеркивал, что только необходимость заставила советских ученых работать над созданием атомного оружия, но главное направление использования атомной энергии – мирное. В 1954 г. дала ток первая в мире атомная электростанция, сооруженная в г. Обнинске Калужской области, примерно в 120-ти километрах от Москвы. Нашей стране принадлежит также первенство в создании гражданского надводного флота с ядерным двигателем – в 1957 г. спущен на воду атомный ледокол «Ленин».
Отечественные ученые внесли достойный вклад в развитие атомной науки и техники. В том, что уже более полувека человечество живет без мировых войн, есть и их немалая заслуга.
2. СТРОЕНИЕ АТОМА И ЯДРА, ДЕФЕКТ МАССЫ, ЯДЕРНЫЕ СИЛЫ
Открытие ядра произошло в 1911 г., в связи с чем появилась новая наука – ядерная физика, изучающая свойства и строение ядер атомов.
Строение атома и ядра
Атом состоит из ядра, содержащего протоны и нейтроны, и электронов, окружающих ядро в виде электронной оболочки.
Самым легким из всех ядер является ядро водорода. В 1920 г. ему присвоили название - протон. Протон имеет единичный (т.е. элементарный, минимально возможный в природе) положительный заряд, равный 1,6·10-19 Кл. Заряд электрона в точности равен заряду протона, но является отрицательным. Электрон также называют негатроном или β-частицей, а поток электронов – β-излучением.
После открытия в 1932 г. нейтрона появилась протон-нейтронная модель ядра, которая пришла на смену существовавшей до этого протон-электронной модели.
Нейтрон не имеет электрического заряда. Отсюда следует, что заряд ядра Z равен сумме зарядов содержащихся в нем протонов, а поскольку атом в обычном состоянии электронейтрален, то число протонов в любом атоме равно числу электронов.
Единицей измерения заряда ядра, как и протона, служит единичный элементарный заряд, поэтому количество протонов в ядре (а, значит, и количество электронов в атоме) равно Z.
Суммарное количество протонов и нейтронов в ядре атома называется массовым числом A. Следовательно, число нейтронов N равно разности величин A и Z.
Ниже будет показана похожесть поведения протона и нейтрона в ядре, в связи с этим им дали общее название – нуклон (т.е. «ядерная частица»). Таким образом, протон – это электрически заряженный нуклон, а нейтрон является нуклоном без электрического заряда. Общее количество нуклонов в ядре равно A.
Протон в свободном (несвязанном) состоянии стабилен, а нейтрон неустойчив и с периодом полураспада примерно 12 минут превращается в протон с испусканием электрона (т.е. претерпевает β-распад) и антинейтрино. Очевидно, что время жизни нейтрона намного больше времени его взаимодействия с ядрами урана в активной зоне, поэтому нестабильность нейтрона при расчетах ядерных реакторов можно не учитывать.
В стабильном ядре нейтрон находится в связанном состоянии и не распадается, поскольку это энергетически невозможно из-за необходимости преодоления энергии связи внутриядерных частиц.
Для дальнейших рассуждений необходимо ввести еще ряд важных понятий.
Химический элемент (или просто – элемент) - это вид атомов, имеющих ядра с одинаковым зарядом. Все элементы включены в периодическую систему Д.И. Менделеева, и каждый из них в этой таблице имеет порядковый номер, равный заряду ядра Z. Порядковый номер еще называют атомным номером или атомным числом.
Произвольное ядро обозначают 
 , где X – символ химического элемента. Например,
, где X – символ химического элемента. Например,  - это ядро урана, который имеет в периодической таблице элементов порядковый номер 92 и массовое число 235. В этом ядре есть 92 протона и (235 – 92) = 143 нейтрона. Допускаются также такие обозначения данного ядра:
- это ядро урана, который имеет в периодической таблице элементов порядковый номер 92 и массовое число 235. В этом ядре есть 92 протона и (235 – 92) = 143 нейтрона. Допускаются также такие обозначения данного ядра: 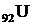 235
235  (т.е. массовое число справа от символа элемента) или U235 (без указания атомного номера), или даже, для краткости, – U5 (в устной речи говорят «уран пятый»).
(т.е. массовое число справа от символа элемента) или U235 (без указания атомного номера), или даже, для краткости, – U5 (в устной речи говорят «уран пятый»).
Нуклидом называется атом с конкретным количеством протонов и нейтронов в ядре (т.е. с определенным массовым числом и порядковым номером) и ядром в основном или метастабильном энергетическом состоянии. Иногда в литературе нуклидом называют и само ядро.
Изотопы – это нуклиды одного и того же химического элемента с различными массовыми числами, стало быть, с одинаковым количеством протонов, но разным количеством нейтронов в ядре. Химические элементы, встречающиеся в природе, имеют в своем составе один или несколько изотопов. Из 326 известных естественных изотопов большинство (280) являются стабильными, а остальные – радиоактивными. Искусственным путем было получено около полутора тысяч изотопов, в том числе более 150 изотопов так называемых трансурановых элементов, о которых будет сказано ниже.
Например, химический элемент водород с зарядом ядра, равным 1, имеет три изотопа:
- легкий водород  (или обычный водород, или просто - водород), в химии его часто называют протием; как уже было сказано выше, ядро легкого водорода назвали протоном, из чего следует, что нейтронов в этом ядре нет;
(или обычный водород, или просто - водород), в химии его часто называют протием; как уже было сказано выше, ядро легкого водорода назвали протоном, из чего следует, что нейтронов в этом ядре нет;
- тяжелый водород  (дейтерий), в ядре которого имеются один протон и один нейтрон; вода D2О, в состав которой входит данный изотоп водорода, называется тяжелой водой - в отличие от легкой, т.е. обычной воды H2О; тяжелая вода в очень незначительных количествах (0,015%) содержится в обычной воде;
(дейтерий), в ядре которого имеются один протон и один нейтрон; вода D2О, в состав которой входит данный изотоп водорода, называется тяжелой водой - в отличие от легкой, т.е. обычной воды H2О; тяжелая вода в очень незначительных количествах (0,015%) содержится в обычной воде;
- тритий  , с одним протоном и двумя нейтронами в ядре; этого изотопа в природе нет, он получается искусственным путем и является радиоактивным с периодом полураспада примерно 12 лет, в то время как протий и дейтерий – стабильные изотопы.
, с одним протоном и двумя нейтронами в ядре; этого изотопа в природе нет, он получается искусственным путем и является радиоактивным с периодом полураспада примерно 12 лет, в то время как протий и дейтерий – стабильные изотопы.
Изотопы водорода можно обозначать без указания порядкового номера и массового числа - H, D и T, а ядра протия, дейтерия и трития, называемые протоном, дейтроном и тритоном, имеют обозначения p, d и t соответственно.
Отметим также, что ядро атома 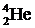 называется α-частицей, а поток этих ядер - α-излучением.
называется α-частицей, а поток этих ядер - α-излучением.
Значительно реже, чем понятие изотоп, используются еще несколько понятий:
- изотоны, т.е. нуклиды с одинаковым числом нейтронов, например, 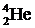 и
и  ;
;
- изобары, т.е. нуклиды с одинаковыми массовыми числами, но разными зарядами ядра, например,  и
и  ;
;
- ядерные изомеры (или просто – изомеры), т.е. радиоактивные нуклиды с одинаковым количеством протонов и нейтронов в ядре, но с разным периодом полураспада; наличие изомеров возможно в тех случаях, когда имеется несколько долгоживущих энергетических состояний ядра - это означает, что ядро способно иметь не только стабильное, но и метастабильное энергетическое состояние; нуклид с ядром в основном состоянии обозначают  , а с ядром в метастабильном состоянии -
, а с ядром в метастабильном состоянии -  ; изомерами, например, являются
; изомерами, например, являются  и
и 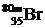 ; в настоящее время известно более 200 ядер, у которых существует один или два метастабильных уровня с различным временем жизни - от долей секунды до нескольких десятков дней.
; в настоящее время известно более 200 ядер, у которых существует один или два метастабильных уровня с различным временем жизни - от долей секунды до нескольких десятков дней.
Массы элементарных частиц, в том числе протона, нейтрона и электрона, а также ядер и атомов измеряются в атомных единицах массы - а.е.м. До международного соглашения 1961 г. эталоном атомной массы служил наиболее легкий из трех имеющихся природных изотопов кислорода -  . В настоящее время за 1 а.е.м. принимают 1/12 массы атома одного из двух существующих природных изотопов углерода -
. В настоящее время за 1 а.е.м. принимают 1/12 массы атома одного из двух существующих природных изотопов углерода - 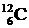 (углерод-12), который стабилен, т.е. нерадиоактивен, в отличие от неустойчивого изотопа
(углерод-12), который стабилен, т.е. нерадиоактивен, в отличие от неустойчивого изотопа  (углерода-14), образующегося в верхних слоях атмосферы под воздействием солнечного и космического излучения.
(углерода-14), образующегося в верхних слоях атмосферы под воздействием солнечного и космического излучения.
Несколько слов об интересной области практического использования свойств тяжелого изотопа углерода. Радиоактивный углерод-14 имеет период полураспада примерно 5730 лет. С помощью высокочувствительных приборов можно измерять интенсивность излучения этого изотопа. Она зависит от концентрации нуклида. Тем самым, можно довольно точно определить возраст какого-либо древнего (в том числе ископаемого) предмета животного или растительного происхождения. Дело в том, что животные и растения поглощают углерод-14 в составе углекислого газа только в течение своей жизни, а после смерти в останках происходит распад ранее накопленного изотопа  . Следовательно, сегодняшняя концентрация углерода-14 в органических останках (кости людей и животных, деревянные орудия труда, обувь и одежда из растительных материалов и т.п.) указывает на возраст изучаемого предмета, т.е. время, прошедшее с момента смерти. Между прочим, именно этим способом в свое время была проверена подлинность многих музейных экспонатов.
. Следовательно, сегодняшняя концентрация углерода-14 в органических останках (кости людей и животных, деревянные орудия труда, обувь и одежда из растительных материалов и т.п.) указывает на возраст изучаемого предмета, т.е. время, прошедшее с момента смерти. Между прочим, именно этим способом в свое время была проверена подлинность многих музейных экспонатов.
Протон, нейтрон и электрон обозначают 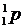 ,
, 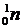 и
и 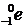 соответственно. Здесь нижний индекс – это заряд, а верхний индекс – приблизительная величина массы частицы в а.е.м. Точные значения приведены в таблице 2.1, где последняя колонка составлена исходя из того, что масса и энергия это – две взаимосвязанные между собой формы существования материи. Количественная связь между ними устанавливается законом пропорциональности массы и энергии, открытым Эйнштейном:
соответственно. Здесь нижний индекс – это заряд, а верхний индекс – приблизительная величина массы частицы в а.е.м. Точные значения приведены в таблице 2.1, где последняя колонка составлена исходя из того, что масса и энергия это – две взаимосвязанные между собой формы существования материи. Количественная связь между ними устанавливается законом пропорциональности массы и энергии, открытым Эйнштейном:
E = mc 2,
где E – полная энергия вещества массой m, Дж; m - масса вещества, кг; c - скорость света в вакууме, равная 3·108 м/с. Это выражение называют также формулой Эйнштейна.
Если масса частицы приведена без указания размерности, то это означает (по умолчанию), что единицей измерения является а.е.м.
В ядерной физике энергия частиц измеряется в электрон-вольтах (эВ). 1 эВ равен энергии, которую приобретает в электрическом поле электрон при прохождении точек с разностью потенциалов 1 В. Соотношение между различными единицами измерения энергии следующее:
1 МэВ = 1,602·10-13 Дж = 4,45·10-20 кВт·ч.
Таблица 2.1
Массы элементарных частиц
| Элементарная частица | Масса покоя в свободном (несвязанном) состоянии | ||
| в граммах | в атомных единицах массы | в мегаэлектрон-вольтах | |
| электрон | 9,109·10-28 | 0,000549 | 0,511 |
| протон | 1,672·10-24 | 1,007276 | 938,279 |
| нейтрон | 1,675·10-24 | 1,008665 | 939,573 |
| для сравнения: 1 а.е.м. | 1,660·10-24 | 1 | 931,5 |
Масса электрона примерно в 1800 раз меньше массы протона или нейтрона. В связи с этим масса атома (или атомная масса) практически равна массе ядра. Она близка к значению A, выраженному в а.е.м., так как массы протона и нейтрона очень незначительно отличаются от 1 а.е.м. Таким образом, атомные массы приблизительно равны массовым числам.
В таблице Д.И. Менделеева приведены атомные массы химических элементов, равные усредненному значению атомных масс имеющихся естественных (т.е. природных) изотопов элемента с учетом доли каждого из изотопов в их природной смеси. Почему, например, атомная масса углерода, указанная в периодической таблице элементов, равна 12,011? Ведь 1/12 массы атома углерода принята за 1 а.е.м., и, казалось бы, атомная масса углерода должна быть равна точно 12. Но ведь эталонным является атом углерода-12, а в природе есть и некоторое количество углерода-14, о чем было сказано выше. Величина 12,011 – это средневзвешенная атомная масса углерода с учетом процентного содержания обоих естественных изотопов.
В природе есть все химические элементы с атомным числом от 1 до 92, кроме технеция Tc (Z = 43) и прометия Pm(Z = 61). Порядковый номер 92 принадлежит урану, поэтому элементы с Z ≥ 93 называют трансурановыми (заурановыми). Они являются искусственными, ибо в природе не встречаются, за исключением плутония Pu (Z = 94), который в очень малых количествах может содержаться в природном минерале – смоляной обманке. Искусственные элементы получены в результате тех или иных ядерных реакций, в частности, методом бомбардировки более легких элементов различными частицами.
А каковы размеры атомов и ядер? Радиус ядра составляет приблизительно 1,4·10-13 · A 1/3 см, т.е. порядка 10-13-10-12 см. Радиус атома в 104-105 раз больше радиуса ядра и составляет примерно 0,5∙10-8 см.
 2018-03-09
2018-03-09 185
185







