Конспект урока "ПЗ и ПСХЭ Д. И. Менделеева в свете учения о строении атома"
Периодический закон является основой современной химии и всего естествознания. Он был открыт Дмитрием Ивановичем Менделеевым 1 марта 1869 года. Дмитрий Иванович Менделеев — великий русский учёный, один из основоположников современной химии, создатель Периодической системы элементов.


Он также является создателем учебника «Основы химии», в котором вся неорганическая химия изложена на основе Периодического закона. Менделеев является автором химической теории растворов.
В 1955 году группа американских учёных во главе с Гленом Сиборгом получила новый 101 элемент, которому присвоено название «менделевий» в честь выдающегося русского учёного.


Периодическая система является графическим выражением периодического закона. Д.И. Менделеев изначально расположил все химические элементы в ряд по увеличению их атомных масс и отметил там отрезки, в которых свойства элементов и их соединений изменялись сходным образом.
|
|
|

На основании этого, им была предложена следующая формулировка закона: свойства химических элементов и образованных ими веществ, находятся в периодической зависимости от их относительных атомных масс.
Физический смысл периодического закона стал понятен только после создания теории строения атома. Но сама эта теория развивалась и развивается на основе периодического закона и периодической системы.
На развитие периодического закона оказала влияние не только теория строения атома, но и открытие явления существования изотопов, а также закон Мозли.
Согласно этому закону, заряд ядра атома каждого элемента в таблице Менделеева возрастает на единицу по сравнению с зарядом ядра атома предыдущего элемента. Поэтому заряд атомного ядра совпадает с порядковым номером элемента в таблице Менделеева. Закон Мозли вскрыл истинный принцип, по которому Менделеев интуитивно расположил химические элементы.


Согласно теории строения атома, его главной характеристикой является положительный заряд ядра. Заряд ядра определяет положение атома в Периодической системе, число электронов в атоме, его электронное строение и все свойства атомов.
Таким образом, современная формулировка периодического закона звучит следующим образом: свойства атомов химических элементов, а также состав и свойства образуемых ими веществ находятся в периодической зависимости от зарядов атомных ядер.
Все химические элементы в Периодической системе расположены в порядке возрастания атомного, или порядкового номера. В каждой ячейке этой Периодической таблицы расположен химический элемент, где есть его название, порядковый номер и относительная атомная масса.
|
|
|

Численная величина атомного номера равна положительному заряду ядра атома соответствующего химического элемента. Кроме этого, порядковый номер указывает число протонов в нём и число электронов. Например, заряд ядра атома водорода равен плюс один, значит в атоме содержится один протон и один электрон.

Количество нейтронов в атоме можно найти по разности между массовым числом и количеством протонов.
Например, для изотопа фосфора тридцать один число нейтронов равно шестнадцати (тридцать один минус пятнадцать).

В Периодической системе химических элементов Д.И. Менделеева семь горизонтальных рядов, которые называются периодами и восемь вертикальных столбов, которые называются группами. Поэтому каждый химический элемент имеет свой порядковый номер, находится в определенном периоде и в определённой группе.

Известно около семи сот форм графического изображения периодической системы. Но их объединяет то, что элементы в них располагаются в порядке возрастания их атомных ядер. Существует два основных варианта представления периодической системы: длиннопериодный, в котором выделяют 18 групп и короткопериодный, в котором групп 8, но вводится понятие главной и побочной подгрупп.

По мере увеличения атомного номера происходит постепенное заполнение электронами соответствующих орбиталей. Таким образом, структура Периодической системы связана с электронной структурой атомов элементов.

В зависимости от того, какой энергетический подуровень заполняется последним, различают четыре семейства элементов: это эс-элементы, у которых последним заполняется эс-подуровень внешнего энергетического уровня, как например, у лития, поэтому литий – эс-элемент.

У элементов пэ-семейства последним заполняется пэ-подуровень, как, например, у фосфора, поэтому фосфор – пэ-элемент, у дэ-элементов последним заполняется дэ-подуровень, как у титана, поэтому титан – дэ-элемент, а у элементов эф-семейства последним заполняется эф-подуровень, как у эйнштэйния, поэтому эйнштэйний является эф-элементом.
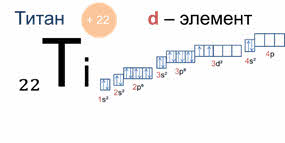

Периодом называют последовательный ряд элементов, в атомах которых электронная конфигурация внешнего энергетического уровня изменяется от эн-эс-один до эн-эс-два эн-пэ-шесть (кроме первого периода).
Номер периода совпадает с номером внешнего энергетического уровня. Поэтому физический смысл номера периода заключается в том, что он указывает число энергетических уровней, на которых находятся электроны в атомах данного элемента.
Малыми считаются с первого по третий период, а большими – с четвёртого по восьмой.
В первом периоде два элемента, во втором и третьем – по восемь элементов, в четвёртом и пятом – по восемнадцать элементов, в шестом и седьмом – по тридцать два элемента.
Каждый период начинается щелочным металлом и заканчивается благородным газом. Первые три периода содержат только эс- и пэ-элементы. Четвёртый, пятый и последующие периоды включают элементы, у которых происходит заполнение дэ-подуровня внешнего энергетического уровня. У элементов шестого и седьмого периодов, кроме эс-, пэ-, дэ-подуровней, заполняются и эф-подуровни третьего снаружи электронного слоя. К эф-элементам относятся лантаниды и актиниды, которые вынесены за пределы таблицы.
В группах находятся элементы, атомы которых имеют схожее электронное строение. Группы делят на А и Б подгруппы: это главная и побочная. А группа содержит больше элементов, чем побочная.
 2020-06-29
2020-06-29 376
376







