В технологических расчётах добычи и транспорта газа часто пользуются основными термодинамическими характеристиками природного газа: теплоёмкостью, энтропией, энтальпией, теплотой сгорания, теплообменом, теплопроводностью.
Теплоёмкость. Теплоёмкостью называют количество теплоты, необходимое для нагревания единицы массы или объёма вещества на 1° С.
Отношение теплоёмкости в массе системы М называется удельной теплоёмкостью:
с = С/М, (31)
а отношение теплоёмкости к количеству вещества – молярной теплоемкостью:
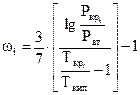 (27)
(27)
где Рат - атмосферное давление;
Ткип - температура кипения компонента при атмосферном давлении.
Ацентрический фактор для многих веществ изменяется от 0,0 до 0,4. Отношение абсолютной критической температуры компонента к абсолютной температуре кипения (при нормальных физических условиях) зависит от типа углеводородов - парафиновых, нафтеновых или ароматических. Для углеводородов парафинового ряда это отношение можно определить, например, по корреляционной зависимости Г. Р. Гуревича
|
|
|
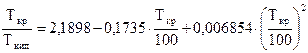 (28)
(28)
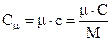 . (32)
. (32)
Единицей количества теплоты, работы, энергии в системе СИ является джоуль (Дж). Джоуль - работа силы 1 Н при перемещении ею тела на расстоянии 1 м в направлении действия силы:
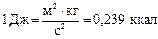
Теплоёмкость выражается в Дж/К, удельная теплоёмкость – в Дж/(кг·K), молярная теплоёмкость – в Дж/(моль К).
Теплоёмкость природных газов зависит от химического состава и состояния, а также от процесса сообщения им теплоты. В адиабатическом процессе С = 0, в изобарическом С = Ср, в изохорическом С = Сv.
Для газов обычно различают теплоёмкости при постоянном объёме Сv и постоянном давлении Ср.
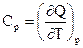
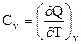 (33)
(33)
где Р = const и V = const.
Сv связана с процессом, характеризующимся тем, что при неизменности объёма вся энергия, сообщаемая газу в форме теплоты, затрачивается на увеличение внутренней энергии газа. Ср связана с процессом, характеризующимся тем, что, нагревая тело, предоставляют ему возможность расширяться при неизменном давлении. Таким образом, часть сообщенной телу теплоты идет на производство работы расширения. Поэтому Ср > Сv.
Для идеальных газов между Ср и Сv существует следующее соотношение в [кал/моль·°С]:
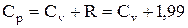 (34)
(34)
где R - газовая постоянная.
В области давлений, где газы считаются идеальными, значения теплоёмкостей постоянны. Однако для реальных газов значения теплоёмкости изменяются в зависимости от давления. Для смеси газов теплоёмкость определяется по сумме теплоемкости входящих компонентов по формуле
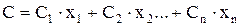 (35)
(35)
где С1, С2…Сn - теплоёмкости отдельных компонентов смеси;
х1, х2…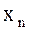 содержание компонентов в долях единицы.
содержание компонентов в долях единицы.
Отношение теплоёмкости 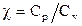 называют показателем адиабаты.
называют показателем адиабаты.
|
|
|
Для сравнительной характеристики различного вида топлива используется понятие удельной теплоты сгорания.
Удельной теплотой сгорания газового топлива называется количество теплоты, которое выделяется при полном сгорании 1 н.м3 или 1 кг газа. Теплоту сгорания газообразного топлива обычно измеряют в ккал/м3 при температуре 0 или 20 0С и давлении 760 мм. рт. ст. расчётным путём по известному химическому составу газа или же с помощью калориметров.
Различают низшую теплоту сгорания Qн и высшую теплоту сгорания Qв.
Высшая теплота сгорания газового топлива соответствует условию, при котором водяные пары продуктов сгорания доводятся до жидкого состояния. В реальных условиях сжигания газа водяные пары не конденсируются, а находятся в парообразном состоянии. Понятие низшей теплоты сгорания относится только к тем газам, которые при сгорании выделяют водяные пары. Разница между Qв и Qн составляет порядка 600 ккал на каждый килограмм водяных паров, т.е. 6 ккал на каждый процент влаги, содержащейся в топливе или образующийся при сгорании водорода, входящего в состав горючего газа.
 2014-02-05
2014-02-05 991
991








