Для гомогенных реакций:
aA(г) + bB(г) Û cC(г) + dD(г), 3Н2+N2Û2NH3
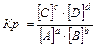 ,
,
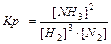
Для гетерогенных реакций:
aA(т) + bB(Г) = cC(Г) + dD(Г), C(т)+ O2(Г) = СО2(Г)
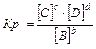
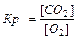
Константа равновесия зависит от природы веществ, температуры. Присутствие катализатора в системе не влияет на значение КР, поскольку он снижает ЕА прямой и обратной реакций на одну и ту же величину и поэтому одинаково изменяет скорости прямой и обратной реакций. Катализатор лишь ускоряет достижение равновесия, он не влияет на количественный выход продуктов реакции. КР не зависит от концентрации реагирующих веществ.
Химическое равновесие является подвижным (динамическим), его можно смещать, изменяя различные факторы (С; Р; T). Сдвиг химического равновесия определяется принципом Ле-Шателье:
если на систему, находящуюся в равновесии оказывать внешнее воздействие, то система противодействует этому воздействию, стараясь его уменьшить.
 2014-02-02
2014-02-02 1239
1239








