Ориентация и реакционная способность в реакциях присоединения
Электрофильное присоединение
Как и в случае электрофильного ароматического замещения, электронодонорные заместители при двойной связи повышают ее реакционную способность в реакциях электрофильного присоединения, а электроноакцепторные – понижают ее.
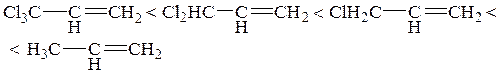
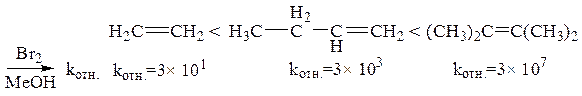
Влияние алкильных групп на скорость электрофильного присоединения
Алкильные группы, как правило, способствуют увеличению скорости электрофильного присоединения.
Если в реакциях электрофильного присоединения образуется циклический интермедиат 2, то введение алкильных заместителей в молекулу этилена приводит к аддитивному ускорению скорости реакции до тех пор, пока все 4 атома водорода не будут замещены на алкильные группы. Наблюдаемая аддитивность является одним из доказательств образования циклического интермедиата типа 2:
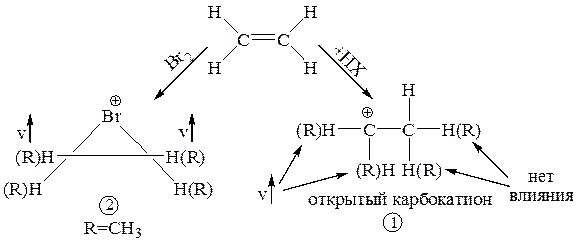
В реакциях электрофильного присоединения галогеноводорода HX ускоряющий эффект не аддитивен. Замена двух водородов при одном из атомов углерода будет значительно ускорять скорость реакции, но дополнительные алкильные заместители у другого атома углерода практически не влияют на скорость реакции. Это есть следствие того, что: 1) если EÅ=HÅ, то циклический карбокатион не может образовываться (так как у водорода нет электронной пары); 2) промежуточно образующиеся открытые карбокатионы типа 1 имеют следующую относительную стабильность: первичные < вторичные < третичные:
|
|
|
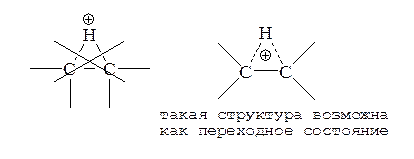
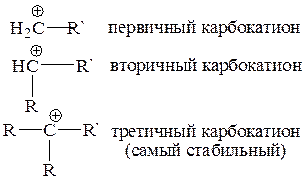
Нуклеофильное присоединение
Нуклеофильное присоединение происходит тем быстрее, чем более двойная связь обеднена электронной плотностью. Эта реакция лучше всего идет с субстратами, содержащим 3 или 4 акцепторных группы. Влияние заместителей настолько велико, что можно утверждать:
простые олефины вообще не реагируют по нуклеофильному механизму, а полигалогено- или полицианоолефины обычно не вступают в реакции, идущие по механизму электрофильного присоединения:
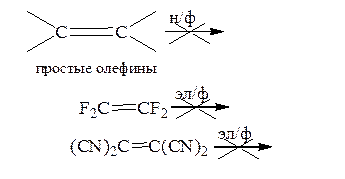
Такие реагенты, как аммиак NH3 и амины NR3, реагируют только как нуклеофилы и присоединяются только к субстратам, чувствительным к нуклеофильной атаке.
Есть реагенты, которые атакуют только как электрофилы, поэтому такие субстраты, как тетрафторэтилен, не будут вступать в реакции с ними.
Известны случаи, когда один и тот же реагент с простыми олефинами реагирует только по электрофильному механизму, а с полигалогено- или полицианоолефинами – по нуклеофильному:
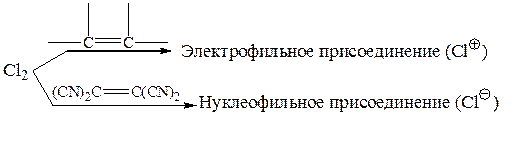
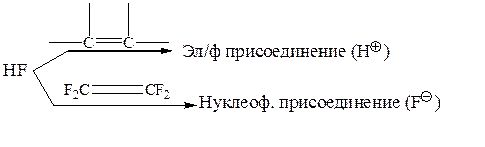
Субстраты Михаэля почти всегда реагируют по нуклеофильному механизму (1,4-присоединение):
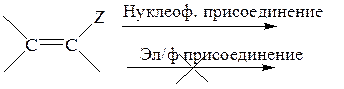
Чем больше акцепторные свойства заместителя Z, тем легче нуклеофильное присоединение.
|
|
|
Активирующая способность заместителей Z в субстратах Михаэля снижается в ряду:
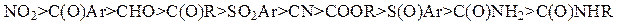
Почему соединения с тройной связью реагируют как электрофилы, а не как нуклеофилы?
Кажется очевидным, что акцепторные заместители способствуют нуклеофильному присоединению и замедляют электрофильное в результате понижения электронной плотности двойной связи. Однако между атомами, связанными тройной связью СºС, «концентрация» электронов выше, чем между атомами С=С, и тем не менее тройные связи менее склонны к реакциям электрофильного присоединения и легче вступают в реакции нуклеофильного присоединения, чем двойные связи (p-ВЗМО и p*-НСМО ацетиленов лежат ниже соответствующих орбиталей алкенов). Это не универсально, но справедливо в большинстве случаев. Все реагенты, способные образовывать мостиковые интермедиаты типа 2, с двойными связями реагируют быстрее, чем с тройными. В то же время присоединение электрофильного протона НÅ (кислотно-катализируемая гидратация, присоединение галогеноводородов) идет примерно с одинаковыми скоростями в случае алкенов и соответствующих алкинов [Марч, т. 3, с. 150; см., однако, новый Сайкс, с. 84: винилкатионы менее стабильны, чем алкилкатионы (см. ниже), и если следовать этой логике, то присоединение НÅ к алкенам должно идти быстрее, чем к алкинам].
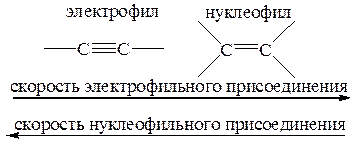
Другим фактором, определяющим различие в реакционной способности алкенов и алкинов в реакциях электрофильного присоединения, является относительная стабильность положительно заряженных интермедиатов.
Если электрофильное присоединение идет через открытый карбокатион (например, присоединение гидрогалогенидов), то винильный карбокатион 9 энергетически менее выгоден по сравнению с алкильным карбокатионом 1:
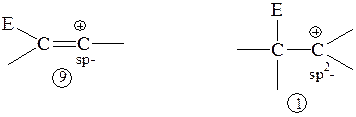
В образующемся при протонировании ацетилена винильном катионе 9 p-связь не участвует в стабилизации карбокатиона, так как ее р-электроны ортогональны р-орбитали, несущей положительный заряд. С учетом того, что в винильном катионе 9 несущий положительный заряд углерод находится в состоянии sp-гибридизации и обладает более высокой электроотрицательностью по сравнению с sp2-гибридизованным положительно заряженным углеродом в алкильном катионе 1, винильный катион 9 должен быть менее стабилен, чем алкильный 1.
В тех случаях, когда электрофильное присоединение идет через промежуточный мостиковый интермедиат типа 2 (BrÅ, IÅ, SRÅ и т. д.), интермедиаты 8 оказываются более напряженными (энергетически менее выгодными) по сравнению с соответствующими интермедиатами 2 (углы между связями при sp2-гибридизованном углероде 120°):
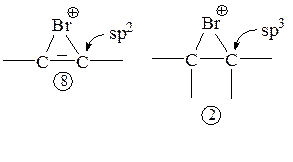
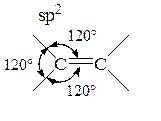
Еще одно объяснение более медленного присоединения таких электрофилов к алкинам по сравнению с алкенами исходит из того, что система 8 антиароматична.
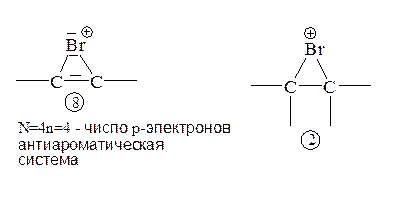
Различной реакционной способности алкинов и алкенов в реакциях электрофильного присоединения могут даны и другие, в принципе сходные объяснения. Одно из них состоит в том, что электроотрицательность sp-гибридизованных углеродов тройной связи больше, чем электроотрицательность sp2-гибридизованных углеродов двойной связи (вспомните: соединения с тройной связью обладают большей кислотностью, ацетиленид-анионы более стабильны, чем этиленид-анионы). Поэтому атакующему электрофилу труднее оторвать пару электронов от такой связи. Другое объяснение заключается в том, что электроны тройной связи более прочно удерживаются из-за меньшего расстояния между атомами углерода.
Как и следовало ожидать, тройные связи с активирующей группой Z вступают в реакции нуклеофильного присоединения особенно хорошо.
Свободнорадикальное присоединение
Свободнорадикальное присоединение может происходить с субстратами любых типов. Главное условие такого присоединения – присутствие в реакционной смеси свободнорадикальных частиц. Такие реагенты, как, например HBr, RSH атакуют по ионным механизмам в отсутствие инициатора, но в его присутствии механизм присоединения меняется на свободнорадикальный:
|
|
|
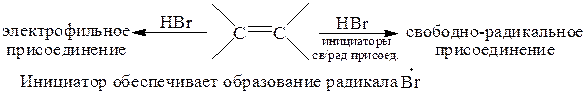
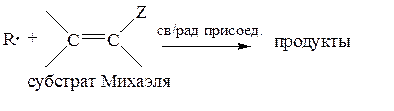
 2014-02-02
2014-02-02 7981
7981







