Строение молекулы бензола
Главным представителем ароматических углеводородов является бензол С6Н6. Он обнаружен М. Фарадеем в 1825 г. в светильном (коксовом)газе, а в 1833 г. получен Э. Митчерлихом сухой перегонкой бензойной кислоты с избытком извести.
Строение молекулы бензола чаще всего выражают формулой, предложенной немецким химиком А. Кекуле (1865 )
 |
Этой формулой пользуются и сейчас, но вкладывают в нее новый смысл.
Согласно Кекуле, бензол — замкнутая система с тремя сопряженными двойными связями — циклогексатриен-1,3,5. Но эта формула, соответствуя элементному составу молекулы бензола, не отвечает многим его свойствам. Например, согласно формуле Кекуле бензол формально является непредельной системой. В то же время онвступает преимущественно в реакции замещения, а не присоединения. Формула Кекуле также не в состоянии объяснить равенства расстояний между углеродными атомами, что имеет место в реальной молекуле бензола. Кроме того, она не может объяснить и высокой устойчивости бензольного кольца. Если исходить из классической формулы Кекуле, у бензола должно быть два орто- изомера:
|
|
|
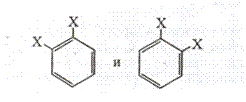 |
Однако известен только один- орто- изомер.
Чтобы выйти из этого затруднения. Кекуле был вынужден допустить возможность постоянного изменения положения двойных связей в молекуле, т.е. выдвинул теорию «осцилляции», согласно которой двойные связи не фиксированы на одном месте.
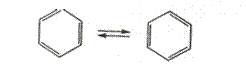 |
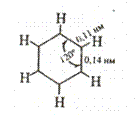 Согласно современном представлениям молекула бензола имеет строение плоского шестиугольника, стороны которого равны между собой и составляют 0,14 нм. Это расстояние является средним значением между величинами 0,154 нм (длина одинарной связи) и 0,134 нм (длина двойной связи). Не только углеродные атомы, но и связанные с ними шесть атомов водорода лежат в одной плоскости. Углы, образованные связями Н-С -С и С-С-С, равны 120°:
Согласно современном представлениям молекула бензола имеет строение плоского шестиугольника, стороны которого равны между собой и составляют 0,14 нм. Это расстояние является средним значением между величинами 0,154 нм (длина одинарной связи) и 0,134 нм (длина двойной связи). Не только углеродные атомы, но и связанные с ними шесть атомов водорода лежат в одной плоскости. Углы, образованные связями Н-С -С и С-С-С, равны 120°:
Все углеродные атомы в молекуле бензола находятся и состоянии sp2- гибридизации. Каждый из них связан тремя своими гибридными орбиталями с двумя такими же орбиталями двух соседних углеродных атомов и одной орбиталью атома водорода, образуя три 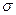 -связи (две связи С-С и одну С-Н-связь).
-связи (две связи С-С и одну С-Н-связь).
Ароматичность — общий признак некоторых циклических органических соединений, обладающих совокупностью особых свойств.
Главной особенностью таких соединений является равномерное распределение 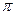 -электронной плотности в плоской циклической молекуле. Наличие единой замкнутой системы
-электронной плотности в плоской циклической молекуле. Наличие единой замкнутой системы 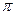 -электронов в молекуле — основной признак ароматичности. Ароматические соединения подчиняются правилу Э. Хюккеля (1931): плоские моноциклические соединения, имеющие сопряженную систему
-электронов в молекуле — основной признак ароматичности. Ароматические соединения подчиняются правилу Э. Хюккеля (1931): плоские моноциклические соединения, имеющие сопряженную систему 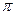 -электронов, могут быть ароматическими, если число этих электронов равно 4 п +2 (где п = 0, 1,2, 3, 4 и т.д., т.е. число
-электронов, могут быть ароматическими, если число этих электронов равно 4 п +2 (где п = 0, 1,2, 3, 4 и т.д., т.е. число 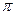 -электронов в молекуле может быть 2, 6, 10, 14. 18 и т.д.
-электронов в молекуле может быть 2, 6, 10, 14. 18 и т.д.
|
|
|
Эти особенности обусловливают все важнейшие физические и химические свойства ароматических соединений. Например, они вступают преимущественно в реакции замещения (в основном электрофильного), а не присоединения (несмотря на формальную ненасыщенность). Ароматические соединения обладают высокой устойчивостью, например к окислителям.
В незамещенной молекуле бензола 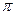 -электронная плотность равномерно распределена между всеми углеродными атомами. Если же в бензольное кольцо ввести хотя бы один заместитель, то такая равномерность будет нарушена. В результате бензольное кольцо становится частично поляризованным и место вхождения второго заместителя будет определяться характером и природой первого заместителя.
-электронная плотность равномерно распределена между всеми углеродными атомами. Если же в бензольное кольцо ввести хотя бы один заместитель, то такая равномерность будет нарушена. В результате бензольное кольцо становится частично поляризованным и место вхождения второго заместителя будет определяться характером и природой первого заместителя.
На основании большого экспериментального материала выведены правила ориентации, в основу которых, положены теоретические представления о перераспределении 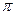 -электронной плотности в бензольном кольце под влиянием заместителей.
-электронной плотности в бензольном кольце под влиянием заместителей.
Заместители, связанные с бензольным кольцом, по своему ориентирующему влиянию на вновь входящие заместители (атакующие реагенты) делят на две группы.
Заместители (ориентанты) первого р о д а: -ОН, -OR, -OCOR, -SH,-SR, CH2R, -CR3, -NH2, -NHCOR, -NHR, (Hal)*. Эти заместители, обладают электронодонорными свойствами, смещают электронную плотность в сторону бензольного кольца. Активируя кольцо, они облегчают вхождение электрофильных реагентов, ориентируя их в орто- и пара- положения. Поэтому такие заместители называют орто- и пара- ориентантами.
При действии нуклеофильных реагентов реакция замещения протекает с большим трудом (при этом реагентов направляется в мета- положение.)
2. 1. Заместители (ориентанты)второго р о д а:
- СN, - COOН, -SO3H, -СНО, -COR, -COOR, -NО2 -N+H3,,ССl3. Они смещают электронную плотность от бензольного кольца, т.е. обладают электроноакцепторными свойствами. Эти заместители дезактивируют бензольное кольцо, затрудняя вхождение электрофильных реагентов. При этом вновь входящий заместитель будет ориентирован в мета- положение. Такие заместители называют мета-ориентантами. В то же время заместители второго рода облегчают реакции с нуклеофильны-ми реагентами, способствуя орто- и пара-ориентации.
Таким образом, замещение атомов водорода в молекуле бензола происходит с учетом природы заместителя, связанного с ядром (если заместителей несколько, то существенную роль играет их взаимное расположение), и характера, атакующего реагента.
Химические свойства ароматических соединений: реакции электрофильного замещения, некоторые реакции присоединения и окисления.
Следует обратить особое внимание на правило ориентации заместителей в бензольном ядре, так как при изучении химических свойств производных ароматических углеводородов возникает необходимость опираться на это правило.
Закончите химические реакции, исходя из правила ориентации заместителей:
1 СН3
|
С
// \
 НС
НС СН + НNО3®
СН + НNО3®
/ //
НС СН
\\ /
СН
2. NO2
|
С
// \
 НС
НС СН + CL2®
СН + CL2®
/ //
НС СН
\\ /
СН
Сабактың қысқаша мазмұны
Ароматты қосылыстар іс жүзінде кеңінен қолданылады. Полимерлер өндірісінде әсіресе фенолформальдегидті, гліфталь, эпоксидті поли эфирлерін алуда көп пайдаланылады. Олар көптеген лак-бояу және желімдегіш материалдардың негізі болып табылады. Ароматты қосылыстардың басты өкілі бензол.
Ароматты қосылыстардың құрылысы бензол молекуласының мысалында қарастырылады. Бензол молекуласында біртұтас тұйық П-электрондық жүйесінің пайда болу схемасы, Э Хюккель ережесіне циклді көмірсутектердің “ароматтық” мағынасы ашылып көрсетіледі; бензол гомологтарының изомерия мен номенклатурасы беріледі.
|
|
|
Ароматты көмірсутектерді алу жолдары келтіріледі; негізгі табиғи шикізаттар: таскөмір мен мұнайдан алу және бензол гомологтарын синтетикалық жолмен алу жолдары беріледі.
Химиялық қасиеттері: электрофильдік орын басу реакциясы, кейбір қосып алу және тотығу реакциялары мысал ретінде көрсетіледі.
Ароматты қосылыстар туындыларының химиялық қасиеттерін оқығанда, әсіресе бензол сақинасындағы орынбасарлардың бағытталу ережесіне баса назар аудару қажет.
Орынбасарлардың бағыттау ережесіне сүйеніп химиялық реакцияларды аяқтаңыздар.
1. СН3
|
С
// \
 НС
НС СН + НNО3®
СН + НNО3®
/ //
НС СН
\\ /
СН
2. NO2
|
С
// \
 НС
НС СН + CL2®
СН + CL2®
/ //
НС СН
\\ /
СН
 2014-02-02
2014-02-02 1547
1547








