Вопрос 3.
По применяемому титранту:
- аргентометрия – титрант AgNO3
- роданометрия – титрант KSC N, NH4SCN (тиоцианатометрия)
N, NH4SCN (тиоцианатометрия)
- меркурометрия титрант – соли Н.g22+ (Hg2(NO3)
По способу фиксирования точки стехиометричности
- без индикатора (равного помутнения, Гей-Люссак до точки просветвления)
- титрование с индикатором (Мора, Фольгарда, Фаянса)
Метод Мора – определяют Cl-, Br-
рН≥7
титрант AgNO3; станд. NaCL
индикатор K2CrO4
Титрование ведут до начала выпадения (от одной капли титранта) красного осадка AgCrO4
Первоначально выпадает AgCL, несмотря на то, что K3(AgCL) ›K3(Ag2CrO4)
K3(AgCL) = 1,8 ∙ 10-10; K3(Ag2CrO4) = 4∙ 10-12, т.к. растворимость AgCL составляет
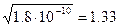 ∙10-5моль/дм3
∙10-5моль/дм3
растворимость  Ag2CrO4 (2S)2 = 4∙10-12
Ag2CrO4 (2S)2 = 4∙10-12
S(Ag2CrO4) = 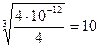 -4моль/дм3
-4моль/дм3
Титровать можно до рН ‹ 10,5, т.к. дальнейшее увеличение рН приводит к образованию Ag2O.
Метод Фаянса - индикаторы – адсорбционные индикаторы – вещества, которые изменяют свою окраску при осаждении (адсорбции) на поверхности осадка.
флуоресцин (CL-) до точки стехиометричности
желто-зеленый
на поверхности осадка образуется слой
отрицательно заряженных ионов CL- (они в избытке)
Посте точки стехиометричности
красный
рН 7…..10
Можно применять эозин (Br-, I-, SCN-)
Родамин G.
Метод Фольгарда – обратное титрование в кислой среде.
CL- + Ag+изб. → AgCL↓ + Ag+ост.
Ag+ост. + SCN- → AgSCN
Индикатор NH4Fe(SO4)2
(NH4Fe(SO4)2∙12H2O) железоалюминиевые квасцы
Лишняя капля SCN- приводит к образованию красного соединения [Fe(SCN)6]3-.
 2014-02-02
2014-02-02 1046
1046








