Способность буферных систем противодействовать резкому изменению рН при добавлении к ним сильной кислоты или основания является ограниченной. Буферная смесь поддерживает рН постоянным только при условии, что количество вносимых в раствор сильной кислоты или щелочи не превышает определенной величины. В противном случае наблюдается резкое изменение рН, т.е. буферное действие раствора прекращается.
Это связано с тем, что в результате протекающей реакции изменяется соотношение молярных концентраций компонентов буферной системы: с(кислоты)/с(соли) или с(основания)/с(соли).
При этом концентрация компонента, реагирующего с добавленной кислотой или щелочью, уменьшается, а концентрация второго компонента возрастает, т.к. он дополнительно образуется в ходе реакции.
Количественно буферное действие раствора характеризуется с помощью буферной емкости (В). При этом различают буферную емкость по кислоте (Вк.) и буферную емкостьпо основанию или щелочи (Во.).
Буферной емкостью по кислоте является то количество химических эквивалентов сильной кислоты, которое нужно добавить к 1 литру (1 дм3) буферной системы, чтобы уменьшить её рН на единицу. Ее можно рассчитать по следующей формуле:
|
|
|
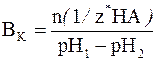
где n(1/z* HA) – число молей химических эквивалентов сильной кислоты, добавленное к 1 дм3 буферной системы; рН1 – водородный показатель системы до добавления сильной кислоты; рН2 – водородный показатель системы после добавления сильной кислоты.
В более общем случае (если брать не 1 дм3 буферной системы, а любой другой ее объем, выраженный в литрах или дм3) формула для подсчета буферной емкости будет иметь следующий вид:
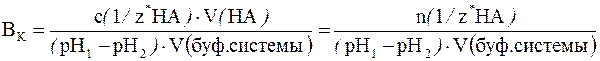
где с(1/z* НА) – молярная концентрация химического эквивалента сильной кислоты в добавляемом растворе; V(НА) – объем (дм3) добавленного раствора сильной кислоты; V(буф. системы) – объем буферного раствора, к которому добавляют раствор кислоты.
Соответственно, буферной емкостью по основанию является то количество химических эквивалентов сильного основания (щелочи), которое нужно добавить к 1 литру (1 дм3) буферной системы, чтобы вызвать увеличение ее рН на единицу:
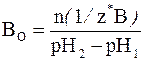
где n(1/z* В) – число молей химических эквивалентов основания, которое добавили к 1 дм3 буферного раствора; рН1 – водородный показатель раствора до добавления основания; рН2 – водородный показатель раствора после добавления основания.
В более общем случае (если брать не 1 дм3 буферной системы, а любой другой ее объем) формула для подсчета буферной емкости по основанию примет следующий вид:
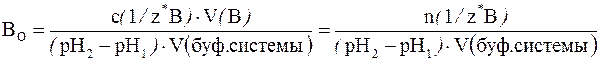
где с(1/z* В) – молярная концентрация химического эквивалента основания в добавляемом растворе; V(В) – объем (дм3) добавленного раствора сильного основания; V(буф. системы) – объем буферного раствора (дм3), к которому добавляют раствор сильного основания.
|
|
|
Чем более концентрированным является буферный раствор, тем выше его буферная емкость, т.к. в этом случае добавление небольших количеств сильной кислоты или щелочи не вызовет существенного изменения концентраций его компонентов, а значит и их соотношения.
Из буферных растворов с одинаковым суммарным содержанием химического количества их компонентов наибольшей емкостью будут обладать те, которые составлены из равного числа молей слабой кислоты и её соли или слабого основания и его соли (рис. 35). В таких растворах молярные концентрации компонентов будут одинаковые, а значит соотношение с(кислоты)/с(соли) = 1 и с(основания)/с(соли) = 1.
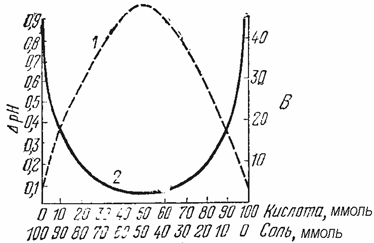
Рис. 35. Изменение буферной емкости (1) и изменение рН кислотной буферной системы при добавлении к ней определенного количества сильной кислоты (2) в зависимости от содержания её компонентов
Данные растворы будут иметь примерно одинаковые значения буферной емкости как по кислоте, так и по основанию.
Если же соотношение концентраций компонентов буферной системы не равно 1, то значения ее буферной емкости по основанию и кислоте будут отличаться друг от друга (причем тем существеннее, чем в большей степени соотношение с(кислоты)/с(соли) и с(основания)/с(соли) отклоняется от единицы).
Например, если в кислотной буферной системе солевой компоненты содержится больше, чем слабой кислоты, то ее буферная емкость по кислоте будет выше, чем по основанию, т.е. Вк. > Во.
Соответственно, буферная емкость по кислоте для основной буферной системы будет больше, чем по основанию, в том случае, если содержание солевой компоненты в этом случае будет меньше, чем слабого основания.
Таким образом, можно сделать вывод, что в данных случаях буферная емкость выше по тому веществу, которое реагирует с избыточным компонентом буферного раствора.
Если буферная система не обладает достаточной буферной емкостью, ее можно повысить, увеличив концентрацию обоих компонентов в необходимое количество раз.
 2014-02-02
2014-02-02 10672
10672
